
 分子中含氧官能团的名称是
分子中含氧官能团的名称是 ,
, ;
;

 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
| A、NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | ||||
| B、将标准状况下112 mL氯气通入10 mL 1 mol?L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 | ||||
C、用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O
| ||||
| D、向澄清石灰水中加入过量的碳酸氢钠溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
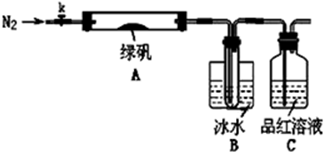
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量食盐 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
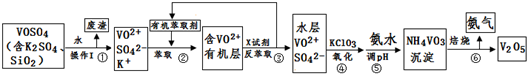
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
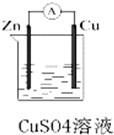 某化学兴趣小组利用如图所示原电池装置进行实验,请回答下列问题:
某化学兴趣小组利用如图所示原电池装置进行实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com