
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( ) 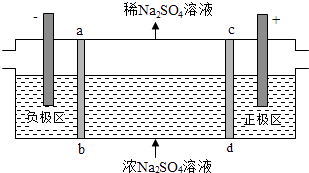
A.通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
【答案】B
【解析】解:A、阴离子向阳极(即正极区)移动,氢氧根离子放电pH减小,故A错误;
B、直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室,通电时,氢氧根离子在阳极区放电生成水和氧气,考虑电荷守恒,两膜中间的硫酸根离子会进入正极区,与氢离子结合成硫酸;氢离子在阴极得电子生成氢气,考虑电荷守恒,两膜中间的钠离子会进入负极区,与氢氧根离子结合成氢氧化钠,故可以得到NaOH和H2SO4产品,故B正确;
C、负极即为阴极,发生还原反应,氢离子得电子生成氢气,故C错误;
D、每生成1mol氧气转移4mol电子,当电路中通过1mol电子的电量时,会有0.25mol的O2生成,故D错误.
故选B.
A、阴离子向阳极(即正极区)移动,氢氧根离子放电pH减小;
B、从两极的电极反应和溶液的电中性角度考虑;
C、负极即为阴极,发生还原反应,氢离子放电;
D、当电路中通过1mol电子的电量时,会有0.25mol的O2生成.


科目:高中化学 来源: 题型:
【题目】甲、乙、丙三位同学分别用如下实验装置及化学药品(碱石灰为氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答问题:
(1)它们制取氨气的化学方程式为:______________________________________。
(2)三位同学都用向下排空气法收集氨气,其原因是_____________________。
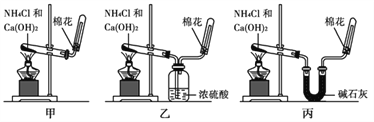
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(实验操作都正确),你认为没有收集到氨气的同学是________填(“甲”、“乙”或“丙”)。
(4)三位同学都认为他们的实验装置还可用于加热碳酸氢铵固体来制取纯净的氨气,你判断能够达到实验目的的是________填(“甲”、“乙”或“丙”),该装置中的NH4HCO3固体能否用NH4Cl固体代替?________(填“能”或“不能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加罗常数的值,下列说法正确的是( )
A.2.4g Mg在足量O2中燃烧,转移的电子数为0.1NA
B.标准状况下,5.6L CO2气体中含有的氧原子数为0.5NA
C.氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA
D.0.1L0.5mol/L CH3COOH溶液中含有的H+数为0.05NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把5.1 g镁铝合金的粉末放入过量的盐酸中,得到5.6 L H2(标准状况下)。试计算:
(1)该合金中铝的质量分数_____________(保留一位小数);
(2)该合金中铝和镁的物质的量之比__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核电荷数小于18的某元素X,其原子核外电子层数为a,最外层电子数为(2a+l)。下列有关元素X的说法中,不正确的是()
A. 元素X的原子核内质子数可能为(2a2-l)
B. 元素X形成的单质既能作氧化剂又能作还原剂
C. 元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数)
D. 由元素X形成的某些化合物,可能具有杀菌消毒的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将7.28g Fe溶于过量的稀H2SO4中,在加热的条件下,用2.02gKNO3去氧化溶液中Fe2+ , 待反应完全后,剩余Fe2+还需0.4mol/L KMnO4溶液25mL才能完全氧化,则KNO3的还原产物( )
A.NO
B.NO2
C.N2O
D.N2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com