
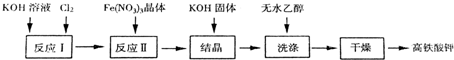
分析 (1)相同温度下,溶度积大的物质向溶度积小的物质转化;
(2)反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑中,Fe元素化合价升高,FeSO4为还原剂,反应中Na2O2的O元素化合价既升高又降低,则Na2O2既是氧化剂又是还原剂,结合元素化合价的变化计算转移电子的数目;
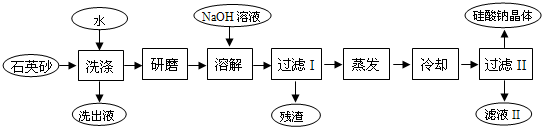
(3)根据流程,得到高铁酸钾,工业上常采用NaClO氧化法生产,原理为:向氢氧化钾中通入氯气,可以得到次氯酸钾溶液,调节pH,向其中加入硝酸铁,次氯酸钾可以将之氧化,3KClO+2Fe(NO3)3+10KOH=2K2FeO4↓+3KCl+6KNO3+5H2O,过滤,即可得到高铁酸钾,向其中加入氢氧化钾固体,可以得到高铁酸钾,用无水乙醇洗涤,干燥得到高铁酸钾.
①氯气与氢氧化钠反应产生强氧化剂次氯酸钠,硝酸铁水解产生氢氧化铁胶体,次氯酸钠将氢氧化铁氧化成高铁酸钠,据此写出氧化过程的离子方程式;已知高铁酸盐热稳定性差,在实际生产中一般控制反应温度30℃以下,其原因是防止生成的高铁酸钠发生分解;
②洗涤晶体表面的杂质离子,同时减少K2FeO4晶体的损失;
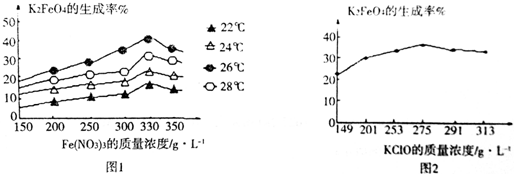
③选择K2FeO4的生成率最高的温度;根据图示求解Fe(NO3)3与NaClO两种溶液最佳质量浓度之比;
(4)①由题目信息可知,铁为阳极电解氢氧化钠溶液,生成FeO42-,由元素守恒还生成水;
②根据电子转移计算铁的质量.
解答 解:(1)相同温度下,溶度积大的物质向溶度积小的物质转化,所以Ksp(K2FeO4)<Ksp(Na2FeO4),
故答案为:<;
(2)反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑中,该反应中Fe元素化合价由+2价变为+6价、过氧化钠中O元素化合价由-1价变为0价和+2价,所以Na2FeO4和氧气为氧化产物,2 mol FeSO4发生反应时,生成2molNa2FeO4,转移8mol电子,同时生成1molO2,反应中共有10mol电子转移,若该反应生成氧气840mL(标准状况下),则反应转移的电子的物质的量为$\frac{840mL×1{0}^{-3}L/mL}{22.4L/mol}×10mol$=0.375mol,
故答案为:0.375;
(3)①氯气与氢氧化钾反应产生强氧化剂次氯酸钾,次氯酸钾将铁离子氧化成高铁酸钾,离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;已知高铁酸盐热稳定性差,在实际生产中一般控制反应温度30℃以下,其原因是防止生成的高铁酸钠发生分解,水解吸热,控制反应温度30℃以下也可抑制K2FeO4与水的反应,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O; 防止生成的高铁酸钠发生分解,抑制K2FeO4与水的反应;
②K2FeO4晶体溶于水,不溶于酒精,所以选用无水乙醇而不用水目的是洗涤晶体表面的杂质离子,同时减少K2FeO4晶体的损失,防止晶体溶解,影响产率;
故答案为:减少K2FeO4的溶解损失;
③由图2可知,温度在26℃时,K2FeO4的生成率最高,故工业生产中最佳温度为26℃,在该温度下生成高铁酸钾的产率最大,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为$\frac{275}{330}$=$\frac{5}{6}$,
故答案为:26;$\frac{5}{6}$;
(4)①由题目信息可知,铁为阳极电解氢氧化钠溶液,生成FeO42-,阳极电极反应式为Fe+8OH--6e-=FeO42-+4H2O,
故答案为:Fe+8OH--6e-=FeO42-+4H2O;
②若维持电流强度为1A,电池工作15分钟,通过电子为$\frac{1A×900s}{96500C/mol}$,则理论消耗铁为$\frac{1A×900s}{96500C/mol}$×$\frac{1}{6}$×56g/mol≈0.087g,
故答案为:0.087.
点评 本题考查考查高铁酸钾的制备,侧重考查阅读题目获取信息的能力、对工艺流程的理解与条件的选择控制,题目难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力,解答本题时注意把握题给信息,学习中注重知识迁移能力的培养.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHCO3=Na++H++CO32- | B. | NH4NO3=NH4++NO3- | ||
| C. | NaHSO4=Na++H++SO42- | D. | Ba(OH)2=Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=+74.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
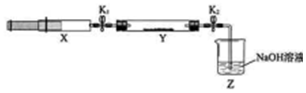
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中红棕色气体慢慢变浅 | ②反应的化学方程式 8NH3+6NO2 $\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
| 打开K2 | ③Z中NaOH溶液产生倒吸现象 | ④反应后气体分子数减少,Y管中压强小于外压 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com