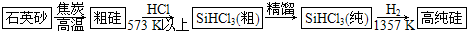观察如图1所示的部分图形,并按要求回答下列问题

(1)由金刚石晶体结构和晶胞图知,金刚石是原子晶体,晶体中碳原子取
杂化轨道形成σ键,每个晶胞中含碳原子数为
个.
(2)白磷分子(P
4)中键角为
,分子的空间结构为
,每1mol白磷分子含
mol P-P共价键.若将1分子白磷中所有P-P键打开并各插入一个氧原子所得氧化物的分子式为
,若每个P原子的孤对电子再与氧原子配位,就可得到磷的另一种氧化物
(填分子式).
(3)由SiO
2晶体结构知SiO
2晶体是
晶体,每1mol SiO
2晶体含
mol Si-O共价键.
(4)已知CaC
2晶体的晶胞结构与NaCl晶体相似,(如图2)但CaC
2晶体中哑铃形C
22-的存在,使晶胞沿一个方向拉长,则CaC
2晶体中Ca
2+配位数(C.N)为
.C
22-与O
22+互为等电子体,O
22+的电子式为
,1molO
22+中含π键数目为
.
(5)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体.其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,观察图形回答.这个基本结构单元由
个硼原子组成,共含有
个B-B键.
(6)若测得mg NaCl固体的体积为Vcm
3,已知NaCl晶体中,靠得最近的Na
+、Cl
-间的距离为a cm,则阿佛加德罗常数N
A的表达式为
.


 ,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,据此答题;
,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,据此答题; ,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,
,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键, ;2NA个;
;2NA个;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
 过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题: 某实验需要用1.0mol?L-1 NaOH 溶液500mL.
某实验需要用1.0mol?L-1 NaOH 溶液500mL.