
����Ŀ����ҵ�ϣ����������з�Ӧ�ϳ������谷�� CaO+3C ![]() CaC2+CO����CaC2+N2
CaC2+CO����CaC2+N2 ![]() CaCN2+C��CaCN2+2H2O=NH2CN+Ca��OH��2 �� NH2CN��ˮ��Ӧ��������[CO��NH2��2]���������غϳ������谷��
CaCN2+C��CaCN2+2H2O=NH2CN+Ca��OH��2 �� NH2CN��ˮ��Ӧ��������[CO��NH2��2]���������غϳ������谷��
��1��д����Ca��ͬһ���ڵ�Crԭ�ӵ���Χ�����Ų�ʽ ��
��2��д��CaC2��������C22����һ�ֵȵ�����Ļ�ѧʽ ��
��3��1mol ���ط���[CO��NH2��2]�к��еĦм���Ҽ�����Ŀ֮��Ϊ ��
��4�������谷�׳ơ�����������ṹΪ  �����е�ԭ�ӵ��ӻ���ʽ�� ��
�����е�ԭ�ӵ��ӻ���ʽ�� ��
��5��CaO������ͼ��ʾ��CaO��������O2�����������Ca2+�ĸ���Ϊ �� CaO������۵��NaCl������۵�ߵ���Ҫԭ���� �� 
���𰸡�
��1��[Ar]3d54s1
��2��N2��CO��CN������дһ��
��3��1��7
��4��sp2��sp3
��5��6��CaO������Ca2+��O2���ĵ������NaCl������Na+��Cl����CaO����ľ����ܴ�
���������⣺��1��Crԭ�Ӻ��������Ϊ24����������Ų�ʽΪ[Ar]3d54s1 �� ���Դ��ǣ�[Ar]3d54s1����2��ԭ��������ͬ���۵����������������������ͬ������Ϊ�ȵ����壬��C22����һ�ֵȵ�����Ļ�ѧʽΪ��N2��CO��CN���ȣ����Դ��ǣ�N2��CO��CN������дһ������3��CO��NH2��2��Cԭ������ԭ��֮���γ�C=O˫����Cԭ����Nԭ��֮���γ�2��C��N������Nԭ����Hԭ��֮�乲�γ�4��N��H���������ǦҼ���˫���к���1���Ҽ���1���м�������1mol ���ط���[CO��NH2��2]�к��еĦм���Ҽ�����Ŀ֮��Ϊ1��7�����Դ��ǣ�1��7����4������Nԭ���γ�2���Ҽ�������1�Թµ��Ӷԣ��ӻ������ĿΪ3����ȡsp2�ӻ���������Nԭ���γ�3���Ҽ�������1�Թµ��Ӷԣ��ӻ������ĿΪ4����ȡsp3�ӻ������Դ��ǣ�sp2��sp3����5��������O2���о�����֮�����Ca2+λ�����ģ�����֮�����Ca2+����6��CaO������۵��NaCl������۵�ߵ���Ҫԭ���ǣ�CaO������Ca2+��O2���ĵ������NaCl������Na+��Cl����CaO����ľ����ܴ� ���Դ��ǣ�6��CaO������Ca2+��O2���ĵ������NaCl������Na+��Cl����CaO����ľ����ܴ�


 ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��鵥���У�ǰ���ܽ����ߴӻ��������û��������ǣ�������
��Al��Fe ��C��Si ��Mg��C ��H2��Cu
A.ֻ�Т٢�B.ֻ�Тڢ�C.ֻ�Т٢ڢ�D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������װ�ÿ�Ӧ����ʵ���������������ն��Ȼ��̵�ʵ�飬�ܴﵽʵ��Ŀ���ǣ������� 
A.��װ�ü���ȡ����
B.��װ���ҳ�ȥ�����е������Ȼ���
C.��װ�ñ������MnCl2��Һ�еĹ���MnO2
D.��װ�ö��Ƶû��յĶ��Ȼ�������Ϊ5.36g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A.ͨ����˵������ϳɲ�����ָ���ϡ��ϳ���ά���ϳ���
B.���ϵ���Ҫ�ɷ��Ǻϳ���֬,�������һЩ���Ӽ�
C.��ľ�ĵȾ����ӹ��Ƴɵ�𤽺��ά���ںϳ���ά
D.�ϳ���ԭ����ú��ʯ�͡���Ȼ����ũ����Ʒ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ֲ��������ȡ�������û�ѧ�����ϳ�ҩ�û�ѧ���ʣ����Ʋ�֢�����������һֱ�ǿ�ѧ���������о��Ŀ��⣮���û�ѧ֪ʶ�����������ء����������֡�����ҩ��Ľṹ���ϳɹ��̣�
��1��2015��ŵ����ҽѧ�������й�Ůҩѧ�������ϣ�����Ϊ���������أ�һ����������ű����ҩ������ȫ���ر��Ƿ�չ�й��ҵ��������˵��������� 
���й��������غ�˫�������أ��ṹ��ͼ1��ʾ����˵��������� ��
A.�����ط����к��й��������������Ѽ�
B.�����صķ���ʽΪC15H22O5
C.��˫��������ת��Ϊ�����صķ�Ӧ��������Ӧ
D.˫�������ط�������2����Ԫ����2����Ԫ��
��2����������һ����������Ѫ�ܼ�����ҩ���ϳ�·����ͼ2�����ַ�Ӧ������ȥ���� 
��֪����![]()
��
��I��A���ڷ���������������
��II��C����D�ķ�Ӧ�������� E��N�ϳɻ����ֵķ�Ӧ������ ��
��III��B��C��ת�������еĻ�ѧ��Ӧ����ʽΪ��
��IV��E�Ľṹ��ʽ�� �� L��M��ת���У������������״�߷��Ӿۺ���þۺ���Ľṹ��ʽΪ ��
��V��K�ж���ͬ���칹�壬��������������K��ͬ���칹�廹���֣�
�����ڷ����廯���� ������FeCl3����ɫ �ۿɷ���ˮ�ⷴӦ��
д����������˴Ź�������ͼ��ʾ��ֵ��Ϊ1��2��2��2��1��ͬ���칹��Ľṹ��ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
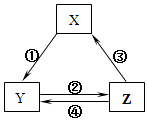
����Ŀ�������и��������У�����֮��ͨ��һ����Ӧ����ʵ����ͼ��ʾת����������Ӧ������ȷ���ǣ�������
ѡ�� | X | Y | Z | ��ͷ���������ֵķ�Ӧ���� |
A | SiO2 | Na2SiO3 | H2SiO3 | ����Na2CO3���� |
B | Na | Na2O2 | NaCl | �ڼ�H2O |
C | NO | NO2 | HNO3 | ����C���� |
D | Al2O3 | NaAlO2 | Al��OH��3 | ����NaOH |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ����ȷ���ǣ� ��
A.������ת������β��������Ӧ�Ļ�ѧ����ʽΪCO+NO ![]() C+NO2
C+NO2
B.���������������������ӷ���ʽΪFe2O3+6H+�T2Fe3++3H2O
C.���������ܲ�����������Һ�п��ܴ��ڴ����ģ�K+��Ba2+��AlO2����Cl��
D.pH=0����Һ�п��ܴ��ڴ����ģ�Na+��Fe2+��SO42����ClO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���桢�������䲻����ѧ�γ����Ľ���Ԫ�أ����ڹ�ҵ������������Ҫ���ã�
��1���������棨CeO2����һ����Ҫ��ϡ���������ƽ�������ʾ����������ҪӦ�ã�CeO2��ϡ�����H2O2�������¿�����Ce3+ �� CeO2�ڸ÷�Ӧ��������
��2����Ȼ�����Cr����Ҫ��+3�ۺ�+6�۴��ڣ�+6�۵�Cr������ϸ����ͻ�䣬�������������ƽ��仹ԭΪ+3�۵ĸ�����ɲ���ƽ�������ӷ���ʽ��
Cr2O72��+SO32��+�TCr3++SO42��+H2O
��3��ʵ��������SnCl2��Һʱ������Ϊ����Sn��OH��Cl������ǣ��ù��̵Ļ�ѧ��Ӧ����ʽΪ �� ������������ڼ���ʱ���Ƶ�SnCl4 �� SnCl4���۵�Ϊ��33�棬�е�Ϊ114�棬SnCl4����ˮ�⣬�ڳ�ʪ�Ŀ������з�������ʵ���ҿ���ͨ����ͼ��ʾװ���Ʊ�SnCl4���г�װ���ԣ��� 
��װ�â��з�����Ӧ�����ӷ���ʽΪ ��
��װ�â��е�����Լ�Ϊ �� װ�â�������Ϊ ��
�ۢ��м��ȵ�����֮һ�Ǵٽ����������۷�Ӧ�����ȵ���һ����Ϊ ��
��Ϊ�ⶨʵ�����������۵Ĵ��ȣ����ʲ��������з�Ӧ����ȡ����Ϊm g��������������ϡ�����У������ɵ�SnSO4��Һ�м��������Fe2��SO4��3��Һ�������ʵ���Ũ��Ϊc molL��1��K2Cr2O7��Һ�ζ����ɵ�Fe2+ �� ����ȥK2Cr2O7��Һ�����ΪV L����������Sn����������Ϊ����֪Fe3+�ɽ�Sn2+����ΪSn4+ �� ���Ի�����Cr2O72���ɱ���ԭΪCr3+����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʹ��M���������ṹ��ʽ��ͼ������˵����ȷ���ǣ� �� 
A.M����ʽΪC8 H11NO2
B.1 mol M��NaOH��Һ��Ӧ����1 mol NaOH
C.M������ķ�Ӧ���ڼӳɷ�Ӧ
D.��M������ͬ�����ŵ�ͬ���칹����8��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com