
【题目】在相同温度下(T=500K),有相同体积的甲、乙两容器,且保持体积不变,甲容器中充入1gSO2和1gO2,乙容器中充入2gSO2和2gO2。下列叙述中错误的是( )
A.化学反应速率:乙>甲B.平衡时O2的浓度:乙>甲
C.平衡时SO2的转化率:乙>甲D.平衡时SO2的体积分数:乙>甲
【答案】D
【解析】
在相同温度下![]() ,有相同体积的甲、乙两容器,且保持体积不变,加入二氧化硫和氧气发生的反应为:
,有相同体积的甲、乙两容器,且保持体积不变,加入二氧化硫和氧气发生的反应为:![]() ,反应是气体体积减小的放热反应,甲容器中和乙容器中相比,乙容器中压强大于甲,反应速率快,二氧化硫转化率增大,由此分析解答。
,反应是气体体积减小的放热反应,甲容器中和乙容器中相比,乙容器中压强大于甲,反应速率快,二氧化硫转化率增大,由此分析解答。
在相同温度下![]() ,有相同体积的甲、乙两容器,且保持体积不变,加入二氧化硫和氧气发生的反应为:
,有相同体积的甲、乙两容器,且保持体积不变,加入二氧化硫和氧气发生的反应为:![]() ,反应是气体体积减小的放热反应,甲容器中和乙容器中相比,乙容器中压强大于甲,反应速率快,相当于平衡正向进行,二氧化硫转化率增大。
,反应是气体体积减小的放热反应,甲容器中和乙容器中相比,乙容器中压强大于甲,反应速率快,相当于平衡正向进行,二氧化硫转化率增大。
A、乙中物质浓度大于甲,化学反应速率:乙>甲,故A正确;
B、乙中物质浓度大于甲,平衡时![]() 的浓度:乙>甲,故B正确;
的浓度:乙>甲,故B正确;
C、乙中等效于甲再加入1g ![]() 和1g
和1g ![]() ,平衡正向进行,平衡时
,平衡正向进行,平衡时![]() 的转化率:乙>甲,故C正确;
的转化率:乙>甲,故C正确;
D、在相同温度下![]() ,有相同体积的甲、乙两容器,且保持体积不变,甲容器中和乙容器中相比,乙容器中压强大于甲,反应速率快,二氧化硫转化率增大,平衡时
,有相同体积的甲、乙两容器,且保持体积不变,甲容器中和乙容器中相比,乙容器中压强大于甲,反应速率快,二氧化硫转化率增大,平衡时![]() 的体积分数:乙<甲,故D错误;
的体积分数:乙<甲,故D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:CH4+2O2+2KOU=K2CO3+3H2O,下列说法正确的是( )

A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池中正极的电极反应式是O2+4e-+4H+=2H2O
C. 反应过程中,乙池的pH逐渐减小
D. 甲池中消耗O2的体积与丙池生成气体的总体积在相同条件下的比值为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制取纯净、干燥氯气的实验装置。

请回答:
(1)装置①的烧瓶中发生反应的化学方程式___。
(2)装置③中所盛试剂的名称是____。
(3)在③~⑤中,有明显错误的一个装置是___(填序号)。
(4)装置⑤的作用是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某化学小组设计的一个用于探究电解原理的实验装置,其中X为阳离子交换膜。下列有关说法正确的是

A.通入甲醚的电扳上发生的电极反应式为![]()
B.乙装置中C电极上生成氢气
C.反应一段时间后,向乙中加入几滴酚酞试液,铁电极附近溶液变红色
D.反应一段时间后,丙装置中两个电极上的质量变化量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池在充放电过程中表现出了良好的循环稳定性,具有较长的循环寿命,放电时的反应为:LixC6+Li1-xFePO4=6C+LiFePO4 。某磷酸铁锂电池的切面如下图所示。下列说法错误的是

A.放电时Li+脱离石墨,经电解质嵌入正极
B.隔膜在反应过程中只允许Li+ 通过
C.充电时电池正极上发生的反应为:LiFePO4-xe-= Li1-xFePO4+xLi+
D.充电时电子从电源经铝箔流入正极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入一定量的NO2,发生反应2NO2(g)![]() N2O4(g)ΔH=﹣57 kJmol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
N2O4(g)ΔH=﹣57 kJmol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )

A. a、c两点的反应速率:a>cB. a、b两点的转化率:a<b
C. a、c两点气体的颜色:a深,c浅D. 由a点到b点,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应过程或实验现象的叙述中,正确的是
A.氨气的水溶液可以导电,说明氨气是电解质
B.漂白粉和明矾都常用于自来水的处理,二者的作用原理相同
C.氯气可以使湿润的有色布条褪色,说明氯气具有漂白作用
D.将装有NO2的密闭烧瓶置于开水中颜色变深,则2NO2(g) ![]() N2O4(g) 的正反应为放热反应
N2O4(g) 的正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于金属锌本身的价值不高,在我国工业锌废料的回收利用率比较低。某课题组研究利用含少量铜、铁的粗锌制备硫酸锌及相关物质的资源综合利用,其工艺流程图(图中加入的物质均为足量)及有关数据如下:
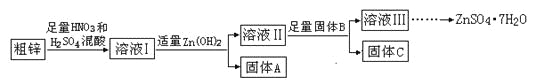
物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
Ksp | 4.0×10—38 | 5.0×10—20 | 2.0×10—16 | 8.5×10—45 | 1.2×10—23 |
请回答下列问题:
(1)固体A的主要成分是_______________;加入固体B的主要作用是____________。
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为_____________________________。
(3)若溶液II中c(Cu2+)为0.05mol·L—1,则溶液II的pH≤_________。
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol·L—1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是___________;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为________________________。
(5)溶液III还可以与(NH4)2S溶液反应制备ZnS,实际生产中选用(NH4)2S溶液而不是Na2S溶液作为反应物,是因为后者制得的ZnS中会含有较多的___________杂质。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com