
 A、B、C、D、E、F为前四周期元素,它们的原子序数依次增大.A、C的基态原子的电子排布中L能层都有两个未成对电子,C、D同主族,E的基态原子的电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.
A、B、C、D、E、F为前四周期元素,它们的原子序数依次增大.A、C的基态原子的电子排布中L能层都有两个未成对电子,C、D同主族,E的基态原子的电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满. .
. .DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.
.DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.分析 A、B、C、D、E、F为前四周期元素,它们的原子序数依次增大,A原子、C原子的L能层中都有两个未成对的电子,则A原子核外电子排布为1s22s22p2,C原子核外电子排布为1s22s22p4,故A为碳元素、C为氧元素;B原子序数介于C、O之间,则B为氮元素;E的基态原子的电子排布中有4个未成对电子,原子核外电子排布为1s22s22p63s23p63d64s2,则E为Fe;F原子除最外能层只有1个电子外,其余各能层均为全充满,F原子核外电子数=2+8+18+1=29,则F为Cu元素;C、D同主族,D的原子序数小于Fe,则D为S元素,据此解答.
解答 解:A、B、C、D、E、F为前四周期元素,它们的原子序数依次增大,A原子、C原子的L能层中都有两个未成对的电子,则A原子核外电子排布为1s22s22p2,C原子核外电子排布为1s22s22p4,故A为碳元素、C为氧元素;B原子序数介于C、O之间,则B为氮元素;E的基态原子的电子排布中有4个未成对电子,原子核外电子排布为1s22s22p63s23p63d64s2,则E为Fe;F原子除最外能层只有1个电子外,其余各能层均为全充满,F原子核外电子数=2+8+18+1=29,则F为Cu元素;C、D同主族,D的原子序数小于Fe,则D为S元素.
(1)A为碳元素,基态原子中电子占据的最高能层为第2能层,符号L,该能层有1个s轨道、3个p轨道,共有5个原子轨道,故答案为:L;5;
(2)E的基态原子的电子排布中有4个未成对电子,原子核外电子排布为1s22s22p63s23p63d64s2,
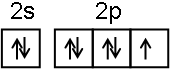
F为Cu,Cu+离子的价层电子排布3d10,其价层电子排布图是 ,
,
故答案为:1s22s22p63s23p63d64s2; ;
;
(3)D元素的最高价氧化物对应的水化物为H2SO4,中心原子的杂化轨道4+$\frac{6-2×2-1×2}{2}$=4,S原子采取sp3杂化方式;B的气态氢化物为NH3,形成3个N-H键、含有1对孤对电子,价层电子对互斥模型为 四面体形,
故答案为:sp3;四面体形;
(4)化合物CO2、N2O和阴离子SCN-互为等电子体,它们结构相似,SCN-中C原子与S、N原子之间形成2对共用电子对,SCN-的电子式为 ,SCN-的水溶液可以用于实验室中Fe3+离子的定性检验,形成配合物的颜色为血红色,
,SCN-的水溶液可以用于实验室中Fe3+离子的定性检验,形成配合物的颜色为血红色,
故答案为: ;血红色;
;血红色;
(5)晶胞中D(S)原子位于晶胞内部,原子数目为8个,E(Fe)原子6个位于面上、4个位于棱上,E(Fe)原子数目=6×$\frac{1}{2}$+4×$\frac{1}{4}$=4,F(Cu)原子位于4个位于面上、1个内部、8个顶点上,原子数目=4×$\frac{1}{2}$+1+8×$\frac{1}{8}$=4,晶体中Cu、Fe、S原子数目之比=4:4:8=1:1:2,故该晶体化学式为:CuFeS2,
晶胞质量=$\frac{(56+64+32×2)g/mol}{{N}_{A}mo{l}^{-1}}$×4,晶胞体积=(b×10-10 cm)2×a×10-10 cm,
该晶体的密度dg•cm-3=($\frac{(56+64+32×2)g/mol}{{N}_{A}mo{l}^{-1}}$×4)÷[(b×10-10 cm)2×a×10-10 cm],
整理可得NA=$\frac{7.36×1{0}^{32}}{da{b}^{2}}$,
故答案为:CuFeS2;$\frac{7.36×1{0}^{32}}{da{b}^{2}}$.
点评 本题是对考查物质结构的考查,涉及核外电子排布、杂化理论、价层电子对互斥理论、等电子体、晶胞计算等,需要学生具备扎实的基础,(5)为易错点、难点,难度中等.


科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
将等物质的量的镁和铝相混合,取四份等质量的该混合物分别加在足量的下列溶液中,充分反应后,放出氢气最多的是( )
A.3 mol/L HCl B.4 mol/L HNO3 C.8 mol/L NaOH D.18 mol/L H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:| 化学键 | H-H | C-H | C-O | O-H |
| 键能(kJ.mol-1 | 436 | 414 | 326 | 464 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 朴硝和消石加强热都不分解 | |
| B. | 朴硝和消石都属于强电解质 | |
| C. | 朴硝和消石都既含有离子键又含有共价键 | |
| D. | “紫青烟起”是由于消石中的K+在火焰上灼烧时呈现出特殊颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
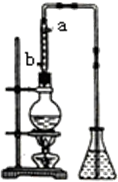 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{H+}{→}$n(C2H4O).
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{H+}{→}$n(C2H4O).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验方案 | 所选玻璃仪器 | |
| A | 除去乙酸乙酯中少量乙醇 | 将混合物中加水,多次水洗分液 | 分液漏斗、烧杯 |
| B | 证明HClO和醋酸的酸性强弱 | 同温下用pH试纸测定浓度为0.1mol•L-1NaClO溶液和0.1mol•L-1CH3COONa溶液的pH | 玻璃棒、玻璃片 |
| C | 由FeCl3溶液得到FeCl3•6H2O晶体 | 向FeCl3溶液中不断滴加盐酸,加热,至有晶体 出现 | 酒精灯、表面皿、玻璃棒 |
| D | 配制1L 0.1mol•L-1的CuSO4溶液 | 将16gCuSO4•5H2O溶于水配成1000mL溶液 | 烧杯、量筒、玻璃棒、1000mL容量瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:| 氢氧化钠溶液体积/mL | 40.00mL | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
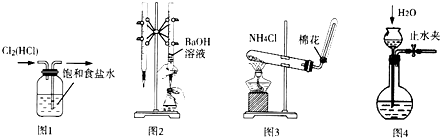
| A. | 用图l所示装置除去Cl2中的HCl杂质 | |
| B. | 用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 | |
| C. | 用图3所示装置实验室制取NH3 | |
| D. | 用图4所示装置检查装置气密性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com