
| A. | H2SO4与K2CO3;HNO3与Na2CO3 | B. | CH3COOH与KOH;HCl与NaOH | ||
| C. | BaCl2与Na2SO4;Ba(OH)2与(NH4)2SO4 | D. | HCl与Na2CO3;HCl与NaHCO3 |
分析 A.反应实质均为氢离子与碳酸根离子反应;
B.醋酸是弱酸,离子方程式中保留化学式;
C.氢氧根离子和铵根离子生成NH3•H2O为弱碱;
D.碳酸氢钠在溶液中电离出碳酸氢根离子.
解答 解:A.H2SO4与NaHCO3、NaHSO4与KHCO3的离子方程式都是HCO3-+H+═H2O+CO2↑,故A错误
B.CH3COOH与KOH反应的离子方程式为:CH3COOH+H+=CH3COO-+H2O,HCl与NaOH反应的离子方程式为OH-+H+═H2O,不能用同一个离子方程式表示,故B错误;
C.氯化钡与硫酸钠反应的离子方程式为SO42-+Ba2+=BaSO4↓,Ba(OH)2与(NH4)2SO4的离子方程式为SO42-+Ba2++2NH4++2OH-=2NH3•H2O+BaSO4↓,不能用同一个离子方程式表示,故C错误;
D.Na2CO3溶液与HCl反应的离子方程式为:CO32-+2H+═H2O+CO2↑,碳酸氢钠与HCl反应的离子方程式为:HCO3-+H+═H2O+CO2↑,不能用同一个离子方程式来表示,故D错误;
故选A.
点评 本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意电解质的强弱及物质的溶解性即可解答,题目难度中等,注重分析能力与知识综合应用能力的训练.


科目:高中化学 来源: 题型:选择题
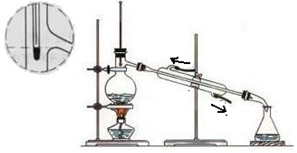
| A. | 冷凝水的进出口方向正确 | B. | 应选用20 mL的蒸馏烧瓶 | ||
| C. | 温度计液泡应插在混合液中 | D. | 锥形瓶中收集到的是甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2、Cl2、SO2依次属于电解质、单质、非电解质 | |
| B. | Na2O2、Cl2、SO2的漂白原理相同 | |
| C. | 等物质的量的Cl2和SO2同时通入品红溶液,褪色更快 | |
| D. | 在Na2O2中阴、阳离子所含的电子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
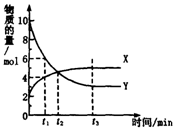 一定温度下在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为5Y?X | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | 根据t2时的数据,可求出该温度下的平衡常数 | |
| D. | t3时,逆反应速率大于正反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠可以用呼吸面具中供氧剂 | |
| B. | 氧化铝的熔点高,可用作耐火材料 | |
| C. | 铝热反应原理是炼铁最常见的反应原理 | |
| D. | 青铜是我国使用最早的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在受热条件下,HD能还原氧化铜 | |
| B. | HD能在氯气中燃烧生成HCl和DCl气体 | |
| C. | 是一种非金属单质 | |
| D. | 是一种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体在熔化状态下能导电 | |
| B. | 在晶体中只要有阴离子就一定有阳离子 | |
| C. | 原子晶体中一定有非极性共价键 | |
| D. | 分子晶体中不一定含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
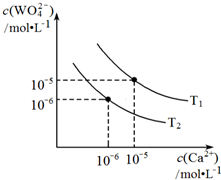 钨酸钙是非常重要的化学原料,主要用于生产钨铁、钨丝及钨合金等钨制品.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙.发生反应:
钨酸钙是非常重要的化学原料,主要用于生产钨铁、钨丝及钨合金等钨制品.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙.发生反应:| 温度/℃ | 25 | 50 | 90 | 100 |
| K1 | 79.96 | 208.06 | 222.88 | 258.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com