

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
分析 硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,硫酸渣中加入稀硫酸,硫酸渣中Fe2O3、Al2O3、MgO都能溶于稀硫酸生成可溶性的硫酸盐,SiO2不和稀硫酸反应,加入FeS2,Fe3+和FeS2发生氧化还原反应生成Fe2+,然后过滤,滤渣A中主要成分是SiO2;滤液中含有Fe2+、Mg2+、Al3+,向滤液中加入NaOH、通入空气,且控制溶液pH,将Fe2+转化为Fe(OH)3沉淀,然后过滤,滤液B中含有Mg2+、Al3+,滤渣中含有Fe(OH)3,然后洗涤、烘干,烘干时Fe(OH)3分解生成Fe2O3,研磨得到Fe2O3即铁红,以此解答该题.
解答 解:(1)氧化铁是碱性氧化物,可以和硫酸反应生成硫酸铁和水,离子方程式为Fe2O3+6H+═2Fe3++3H2O,
故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)还原过程中加入FeS2粉增大溶液中Fe2+的含量,同时有H2SO4生成,根据反应物和生成物书写离子方程式为FeS2+14 Fe3++8H2O=15Fe2++2SO42-+16H+,检验铁离子,可取少量试液于试管中,滴入几滴KSCN溶液,若不显红色,则说明Fe3+已被完全还原,
故答案为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+;取少量试液于试管中,滴入几滴KSCN溶液,若不显红色,则说明Fe3+已被完全还原;
(3)通入空气、加入NaOH可以将溶液中的铁元素充分转化为氢氧化铁沉淀而析出,即4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓ 或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓ 或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)根据几种离子沉淀的pH,使Fe3+沉淀完全的PH为3.2,其他离子开始沉淀PH为3.8,因此所选PH因介于3.2和3.8之间,
故答案为:3.2~3.8;
(5)因二氧化硅不与硫酸反应,故“滤渣A”主要成份为SiO2;未沉淀的离子为Na+、Mg2+、Al3+,故滤液B可以回收的物质有Na2SO4、Al2(SO4)3、MgSO4,
故答案为:Al2(SO4)3、MgSO4、Na2SO4.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生知识综合应用能力,涉及化学反应速率影响因素、离子方程式的书写、离子检验、难溶物的溶解平衡等知识点,明确化学原理、离子方程式书写规则、离子检验方法是解本题关键,要明确流程图中各个步骤可能发生的反应、基本操作方法及所用仪器等,题目难度不大.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:实验题
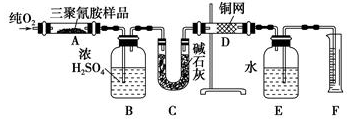
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
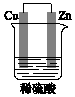 某原电池装置如图所示.
某原电池装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示的过程是目前直接利用太阳能的研究热点.人们把通过人工光化学手段合成燃料的过程叫做人工光合作用.
如图所示的过程是目前直接利用太阳能的研究热点.人们把通过人工光化学手段合成燃料的过程叫做人工光合作用.| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,用0.01mol•L-1的氢氧化钠溶液滴定20mL同浓度的HA溶液,滴定曲线如图所示[AG=1g$\frac{c({H}^{+})}{c(O{H}^{-})}$].下列有关叙述正确的是( )
25℃时,用0.01mol•L-1的氢氧化钠溶液滴定20mL同浓度的HA溶液,滴定曲线如图所示[AG=1g$\frac{c({H}^{+})}{c(O{H}^{-})}$].下列有关叙述正确的是( )| A. | 由图可知HA为强酸 | |
| B. | 滴定终点应为于OA段之间 | |
| C. | A点对应溶液中:c(A-)=c(Na+) | |
| D. | 当滴入NaOH溶液10mL时,所得溶液中:c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 甲,乙两同学用图所示装置进行实验探究硝酸与铁反应的产物.
甲,乙两同学用图所示装置进行实验探究硝酸与铁反应的产物.| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余,得100mL的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Fe在0.1 mol Cl2中充分燃烧,转移的电子数为0.3NA | |
| B. | 1 mol CnH2n+2分子中含共价键数目为(3n+1)NA | |
| C. | 含NA个氧原子的O2与含NA个氧原子的O3的质量比为2:3 | |
| D. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com