
| A、第三周期主族元素中氯的原子半径最大 |
| B、原子最外层电子数为2的元素一定位于周期表中的第ⅡA族 |
| C、同主族自上而下,其非金属元素气态氢化物的稳定性逐渐增强 |
| D、镓(Ga)位于第4周期、ⅢA族,其最高价氧化物对应水化物的化学式为Ga(OH)3 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 |
| B、某温度下,pH=6的蒸馏水显酸性 |
| C、氯气有毒,因而自来水的杀菌消毒一定不能使用氯气 |
| D、明矾可用于水的净化与杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
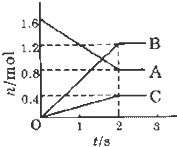 某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为
某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向饱和食盐水中先通足量CO2气体,再通入足量NH3,会析出NaHCO3晶体 |
| B、使用一定的催化剂可将汽车尾气中的CO和NO转化成CO2和N2 |
| C、将一定质量不同组成的铝钠合金投入足量盐酸中,铝的质量分数越小,放出的H2越多 |
| D、等质量的两份铝,分别和含n mol HCl和n mol NaOH 溶液反应,放出的气体的体积一定是NaOH溶液的多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com