
用惰性电极电解饱和食盐水,当电源提供给0.2 mol电子时停止通电。若此溶液体积为2L,则所得电解液的pH是
A.1 B.8 C.13 D.14
科目:高中化学 来源:2014-2015学年黑龙江省绥化市三校高二上学期期中化学试卷(解析版) 题型:填空题
(8分)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:(按照要求用 a、 b 、c表示)
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是______________。
(3)当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是________________。
(4)若三者c(H+)相同时,物质的量浓度由大到小的顺序是________________。
(5)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是____________。
(6)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为________,反应所需时间的长短关系是_________
(7)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是_________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市三校高一上学期期中化学试卷(解析版) 题型:选择题
溶液、胶体和浊液这三种分散系的本质区别是
A.是否有丁达尔现象 B.是否能通过滤纸
C.分散质粒子的大小 D.是否均一、透明、稳定
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高二10月月考化学试卷(解析版) 题型:选择题
Mg?AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为
2AgCl+ Mg === Mg2++ 2Ag +2Cl-。有关该电池的说法正确的是
A.Mg为电池的正极
B.负极反应为AgCl+e-===Ag+Cl-
C.不能被KCl 溶液激活
D.可用于海上应急照明供电
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高二10月月考化学试卷(解析版) 题型:选择题
为了防止钢铁锈蚀,下列防护方法中正确的是
A.在精密机床的铁床上安装铜螺钉
B.在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中
C.在海轮舷上用铁丝系住锌板浸在海水里
D.在地下输油的铸铁管上接直流电源的正极
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高二10月月考化学试卷(解析版) 题型:选择题
有关甲、乙、丙、丁四个图示的叙述正确的是
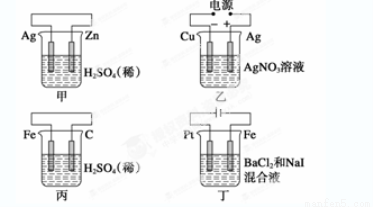
A.甲中负极反应式为2H++2e-===H2↑
B.乙中阳极反应式为Ag++e-===Ag
C.丙中H+向碳棒方向移动
D.丁中电解开始时阳极产生黄绿色气体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高一10月月考化学试卷(解析版) 题型:填空题
取1.43 g Na2CO3·10H2O溶于水配成100 mL溶液,Na+ 物质的量浓度为 ;取出20 mL该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.004 mol/L,加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高一10月月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列对0.3mol/L硫酸钾溶液不正确的说法是( )
A. 1L溶液中含有0.6NA个钾离子
B. 1L溶液中含有钾离子和硫酸根离子总数为0.9NA
C. 2L溶液中钾离子浓度为1.2mol/L
D. 2L溶液中含有0.6NA个硫酸根离子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江安达市高二第一次月考试卷化学试卷(解析版) 题型:选择题
管道煤气的主要成分是H2、CO和少量的甲烷。相应的热化学反应方程式为:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol
当使用管道煤气的用户改用天然气后,在相同条件下燃烧等体积的天然气,
理论上所获得的热值,前者大约是后者的多少倍( )
A.0.8 B.1.3 C.3.1 D.0.32
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com