
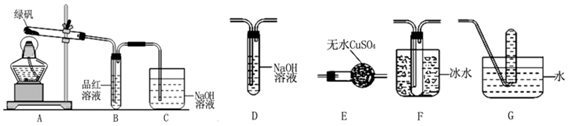
分析 (1)二氧化硫具有漂白性可以使品红溶液褪色,装置C中氢氧化钠可以吸收二氧化硫避免二氧化硫排放到空气中污染空气,根据题意SO3氧化性及脱水性较浓硫酸强,二氧化硫能漂白某些有机染料;
(2)①检验绿矾分解气态产物,由A分解绿矾,经E干燥,二氧化硫三氧化硫均能漂白品红,故先检验三氧化硫并与二氧化硫分离,三氧化硫熔沸点低,故连接F装置冷凝三氧化硫,由装置B检验二氧化硫,经过装置D除去二氧化硫,连接装置G,收集氧气
②利用氧气的助燃性检验氧气;
③二氧化硫具有漂白性可以使品红溶液褪色;
(3)为证明绿矾分解产物中含有三价铁,选用的实验仪器有试管,药匙和胶头滴管,根据三价铁离子使KSCN溶液显红色分析.
解答 解:(1)甲组由此得出绿矾的分解产物中含有SO2,装置B为品红,二氧化硫有漂白性,故装置B中褪色;二氧化硫污染环境,用氢氧化钠吸收,装置C的作用是;吸收尾气,防止SO2(SO3)等气体扩散到空气中污染环境,根据题意SO3氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红,三氧化硫的漂白不可恢复,乙对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中肯定有三氧化硫,未对二氧化硫检验,故可能含有二氧化硫,
故答案为:品红溶液褪色;吸收尾气,防止SO2(SO3)等气体扩散到空气中污染环境;BC;
(2)①检验绿矾分解气态产物,由A分解绿矾,经E干燥,二氧化硫三氧化硫均能漂白品红,故先检验三氧化硫并与二氧化硫分离,三氧化硫熔沸点低,故连接F装置冷凝三氧化硫,由装置B检验二氧化硫,经过装置D除去二氧化硫,连接装置G,检验氧气;
故答案为:AEFBDG;
②氧气收集在G中,利用氧气支持燃烧检验,方法为:把G中的导管移出水面,撤走酒精灯,用姆指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气;
故答案为:把G中的导管移出水面,撤走酒精灯,用姆指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气;
③能证明分解产物中有SO2的实验现象是品红溶液退色,
故答案为:品红溶液退色;
(3)三价铁使KSCN溶液显红色,为证明绿矾分解产物中含有三价铁,则应用药匙取用分解产物于试管中,加盐酸溶解,再用胶头滴管向其中滴入KSCN溶液,若变红,则含有三价铁离子;
故答案为:胶头滴管;盐酸,KSCN溶液.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、根据实验目的及物质的性质进行排列顺、实验基本操作能力及实验方案设计能力,综合性较强,注意把握物质性质以及对题目信息的获取于使用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H、Be、B 原子最外层电子数依次增多 | |
| B. | P、S、Cl 元素最高正化合价依次升高 | |
| C. | F2、Cl2、Br2、I2的熔点依次降低 | |
| D. | Li、Na、K、Rb的金属性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:5 | B. | 1:4 | C. | 3:2 | D. | 5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 制氯乙烷:CH2=CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl | |
| B. | 制甲基丙烯酸甲酯:CH3C≡CH+CO+CH3OH $\stackrel{Pd}{→}$ CH2=C(CH3)COOCH3 | |
| C. | 制CuSO4:2Cu+O2=2CuO,CuO+H2SO4(稀)═CuSO4+H2O | |
| D. | 制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V=150 mL | B. | m1=14.6g | ||
| C. | 白色沉淀最大量为15.6g | D. | m2=10.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
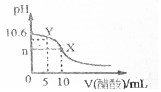 已知常温下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.01mol•L-1的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示.已知100.4=2.5.下列说法错误的是( )
已知常温下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.01mol•L-1的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示.已知100.4=2.5.下列说法错误的是( )| A. | n=7 | |
| B. | 水的电离程度先增大再减小 | |
| C. | 常温下醋酸的电离常数约是1.67×10-5 | |
| D. | Y点溶液中c(NH3•H2O)+c(OH-)=c(CH3COO-)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向硝酸溶液中加入碳酸钠,有大量气泡产生 | 酸性:碳酸>硝酸 |
| B | 向1mL 某溶液中,滴入2mL 0.1mol•L-1 NaOH溶液,加热,产生使湿润的红色石蕊试纸变蓝的气体 | 某溶液中含NH4+ |
| C | 取5mL 0.1mol•L-1FeCl3溶液,滴加5滴0.1mol•L-1KI溶液,振荡,再加入5mL CCl4,振荡,静置,取上层液体,向取出来的溶液中滴加KSCN溶液,显血红色. | KI和FeCl3反应有一定的限度 |
| D | 加热使冰化成液态水 | 分子内H-O键发生断裂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com