
| A. | ①②③ | B. | ③②① | C. | ②①③ | D. | ②③① |
分析 据题意体积相同的①O2、②N2、③CO2即物质的量相等,可设物质的量为1mol,然后利用化学反应方程式分别计算反应后的固体产物的质量,比较大小可以得出答案.
解答 解:①1mol的氧气与镁完全反应生成物的质量为x,
2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$2MgO
1mol 80
1mol x
解得x=80克,
②设1mol的氮气中完全燃烧生成物的质量为y,
3Mg+N2 $\frac{\underline{\;点燃\;}}{\;}$ Mg3N2
1mol 100
1mol y
解得y=100克
③设1mol的二氧化碳中完全燃烧生成物的质量分别为z1和z2,则
2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$ 2MgO+C
1mol 80 12
1mol z1 z2
解得z1=80克,z2=12克,即镁在二氧化碳中完全燃烧生成物的质量为92克,
足量的镁条分别在体积相同的①O2、②N2、③CO2充分燃烧,所得固体的质量由大到小的正确顺序是为②>③>①.
故选D.
点评 本题考查学生利用化学反应方程式进行计算,学生应注意解答的规范化,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氯元素的相对原子质量为$\frac{12b}{a}$ | |
| B. | mg该氯原子的物质的量一定是$\frac{m}{(a{N}_{A})}$mol | |
| C. | 该氯元素的摩尔质量是aNA | |
| D. | ng该氯原子所含的电子数为$\frac{n}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 (g)△H=-106kJ•mol-1
(g)△H=-106kJ•mol-1 +AgO 快
+AgO 快| A. | 反应的活化能等于106kJ•mol-1 | |
| B. | AgO2也是反应的催化剂 | |
| C. | 增大乙烯浓度能显著提高环氧乙烷的生成速率 | |
| D. | 理论上0.7mol乙烯参与反应最多可得到0.6mol环氧乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将镁、铝的混合物共0.2mol,溶于200mL4mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.请回答下列问题:,
将镁、铝的混合物共0.2mol,溶于200mL4mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.请回答下列问题:,查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
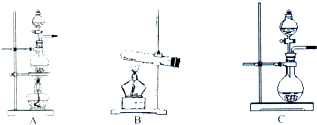 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | C |
| ② | 制氨气 | NH4Cl→NH3 | B |
| ③ | 制氯气 | HCl→Cl2 | A或C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯是1825年由俄国科学家门捷列夫发现的 | |
| B. | 苯与乙烯一样,是很重要的化工原料,可作消毒剂、有机溶剂、洗涤剂 | |
| C. | 苯的分子式中碳原子远没有饱和,因此能使溴水和高锰酸钾褪色 | |
| D. | 苯环上的碳碳键是一种介于单键和双键的独特的键,苯既能发生取代反应也能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

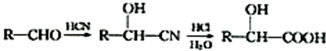
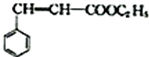
 ;C 的化学名称为苯乙醛.
;C 的化学名称为苯乙醛.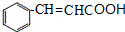 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$ +H2O.
+H2O.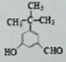
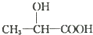 )的路线(其他试剂任选)
)的路线(其他试剂任选)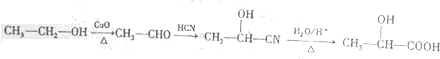 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
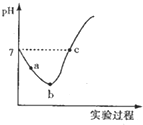 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验过程中可用pH试纸测定溶液的pH | |
| B. | a点的溶液中:C(H+)=c(Cl-)+c(HCl0)+c(OH-) | |
| C. | c 点所示溶液中;c(Na+)=2c(ClO )+c(HCIO) | |
| D. | 由a点到b点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com