
下列说法中正确的是
A. 同温同压下,据有相同数目分子的气体必具有相同的体积
B. 等质量的O2和H2的物质的量之比为16∶1
C. 不同的气体若体积不等,则它们所含的分子数一定不等
D. 同温同体积下,两种气体的物质的量之比等于压强之反比
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是( )
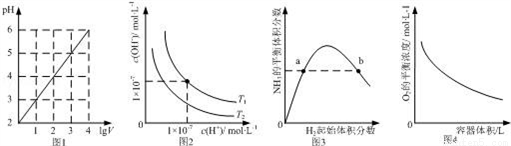
A. 图1表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化
B. 图2表示不同温度下水溶液中H+和OH﹣浓度的变化的曲线,图中温度T2>T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s) 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高一下学期分班考试化学试卷(解析版) 题型:选择题
下列对于Na2O、Na2O2的比较正确的一项是( )
A. Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B. Na2O、Na2O2都是易溶于水(与水反应)的白色固体
C. Na2O2在和CO2的反应中既是氧化剂又是还原剂
D. Na2O2与水反应时,1 mol Na2O2转移2 mol电子
查看答案和解析>>
科目:高中化学 来源:2017届江西省协作体高三下学期第一次联考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列有关说法中正确的是( )
A. 10g46%的乙醇水溶液中所含氢原子的数目为0.6NA
B. 0.1mol·L-1AlCl3溶液中含有Cl-数目为0.3NA
C. 5.6g乙烯和环丁烷(C4H8)的混合气体中含的碳原子数为0.4 NA
D. 11.2LCO2与足量的Na2O2充分反应,转移的电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三下学期开学考试理综化学试卷(解析版) 题型:选择题
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列说法正确的是
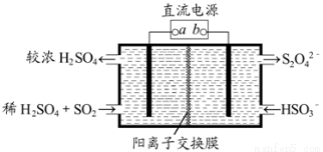
A. a为直流电源的负极
B. 阴极的电极反应式为:2HSO3-+2H2O+2e-=S2O42-+2OH-
C. 阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+
D. 电解时,H+由阴极室通过阳离子交换膜到阳极室
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高二上学期开学检测化学试卷(解析版) 题型:实验题
为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图一、图二所示的实验。
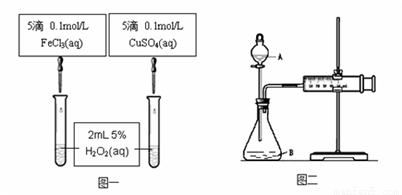
(1) 图一可通过观察____________________现象来定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是__________________,你认为还可以作其他何种改进? _____________________。
(2) 图二可用于定量比较反应的快慢,检查图二装置气密性的方法是________________。
利用图二做实验时需测量的数据是_____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高二上学期开学检测化学试卷(解析版) 题型:选择题
在体积都为1L、pH都等于2的盐酸和醋酸溶液中,投入0.65g锌粒,则下列各图所示内容比较符合客观事实的是
A. 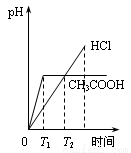 B.
B. 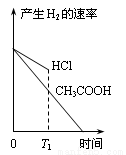 C.
C. 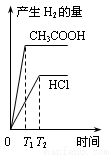 D.
D. 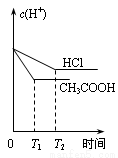
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三2月月考理科综合化学试卷(解析版) 题型:简答题
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g)?2SO3(g),平衡混合体系中 SO3的百分含量和温度的关系如图1所示,根据图1回答下列问题:
①2SO2(g)+O2(g)?2SO3(g)的△H____0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是____.
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4mol 电子,同时消耗2mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)?2NH3(g).图2表示在此反应过程中的能量的变化,图3表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图4表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.
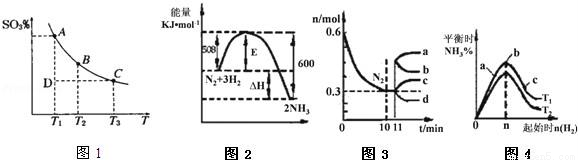
①该反应的平衡常数表达式为_____,升高温度,平衡常数______(填“增大”或“减小”或“不变”).
②由图2信息,计算0~10min内该反应的平均速率v(H2)=______,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为______(填“a”或“b”或“c”或“d”).
③图3a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是______点,温度T1______T2(填“>”或“=”或“<”).
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_____性,所得溶液中c(H+)﹣c(OH﹣)=_________________(填写表达式)(已知:H2SO3:Ka1=1.7×10﹣2,Ka2=6.0×10﹣8,NH3•H2O:Kb=1.8×10﹣5)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省马鞍山市高二上学期期末考试化学试卷(解析版) 题型:选择题
已知一定条件下断裂1 mol下列化学键生成气态原子需要吸收的能量如下:H—H 436 kJ;Cl—Cl 243 kJ;H—Cl 431 kJ。下列所得热化学方程式或结论正确的是:
A. 2HCl(g)===H2(g)+Cl2(g)的反应热ΔH<0
B. H(g)+Cl(g)===HCl(g) ΔH=+431 kJ·mol-1
C. 相同条件下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH相等
D. H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com