
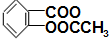 )2]的消炎作用比阿司匹林强十多倍,它为亮蓝色结晶粉末,遇强酸解离为阿司匹林(
)2]的消炎作用比阿司匹林强十多倍,它为亮蓝色结晶粉末,遇强酸解离为阿司匹林(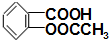 ,M=180)和Cu2+;
,M=180)和Cu2+;| 阿司匹林溶解质量 | 阿司匹林铜的溶解质量 | |
| 氯仿 | 0.4g | 不溶 |
| 无水乙醇 | 0.9g | 不溶 |
| 蒸馏水 | 不溶 | 不溶 |
| 实验编号 | 阿司匹林:无水硫酸铜/物质的量之比 | 产率% | ||
| X1 | X2 | 平均值 | ||
| 1 | 1:1 | 76.6 | 78.1 | 77.4 |
| 2 | 2:1 | 78.6 | 75.1 | 76.8 |
| 3 | 3:1 | 93.9 | 95.9 | 94.9 |
分析 (1)Na2S2O3溶液因水解而使溶液呈碱性,所以只能盛放在碱式滴定管;
(2)根据实验一的流程可知,阿司匹林钠中加入硫酸铜溶液可得阿司匹林铜沉淀,根据分离固体和液体的实验确定操作步骤;
(3)根据表中数据知,阿司匹林与无水硫酸铜的物质的量之比越大其产率越大;
(4)阿司匹林铜固体表面有硫酸钠等杂质,而阿司匹林铜不溶于水,阿司匹林铜中有酯基,遇碱性溶液会水解,据此选择洗涤的溶液;
(5)根据实验原理,实验二中是用Na2S2O3溶液滴定被铜离子氧化生成的碘单质,用淀粉溶液作指示剂,到达滴定终点时,溶液的蓝色会褪去;
(6)碘化亚铜会强力吸附碘单质,实验中如果不加入KSCN试剂会使部分碘单质被碘化亚铜吸附,而使滴定消耗的Na2S2O3溶液偏小,据此判断;
(7)根据反应2Cu2++4I-═2CuI+I2;I2+2S2O32-═2I-+S4O62-;可得关系式2Cu(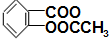 )2~2Cu2+~I2~2S2O32-,根据Na2S2O3的物质的量可计算出样品中Cu(
)2~2Cu2+~I2~2S2O32-,根据Na2S2O3的物质的量可计算出样品中Cu(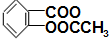 )2的质量,进而确定阿司匹林铜样品的纯度;
)2的质量,进而确定阿司匹林铜样品的纯度;
解答 解:(1)Na2S2O3溶液因水解而使溶液呈碱性,所以只能盛放在碱式滴定管,
故答案为:碱式;
(2)根据实验一的流程可知,阿司匹林钠中加入硫酸铜溶液可得阿司匹林铜沉淀,从混合物中获得阿司匹林铜的操作步骤为:过滤、洗涤、干燥,
故答案为:过滤、洗涤、干燥;
(3)根据表中数据知,阿司匹林与无水硫酸铜的物质的量之比越大其产率越大,所以实验时原料用量应控制阿司匹林过量,
故答案为:阿司匹林;
(4)阿司匹林铜固体表面有硫酸钠等杂质,而阿司匹林铜不溶于水,阿司匹林铜中有酯基,遇碱性溶液会水解,所以可选择酸性的氯化铁溶液洗涤,故选B;
(5)根据实验原理,实验二中是用Na2S2O3溶液滴定被铜离子氧化生成的碘单质,用淀粉溶液作指示剂,判断到达滴定终点的现象是滴入最后一滴Na2S2O3溶液,蓝色褪去,且半分钟内不恢复蓝色,
故答案为:滴入最后一滴Na2S2O3溶液,蓝色褪去,且半分钟内不恢复蓝色;
(6)碘化亚铜会强力吸附碘单质,实验中如果不加入KSCN试剂会使部分碘单质被碘化亚铜吸附,而使滴定消耗的Na2S2O3溶液偏小,进而会使实验结果偏低,
故答案为:偏低;
(7)根据反应2Cu2++4I-═2CuI+I2;I2+2S2O32-═2I-+S4O62-;可得关系式2Cu(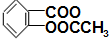 )2~2Cu2+~I2~2S2O32-,根据题意,Na2S2O3的物质的量为0.1mol•L-1×18.60mL=1.860×10-3 mol,根据关系式可知样品中Cu(
)2~2Cu2+~I2~2S2O32-,根据题意,Na2S2O3的物质的量为0.1mol•L-1×18.60mL=1.860×10-3 mol,根据关系式可知样品中Cu(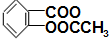 )2的物质的量为1.860×10-3 mol,阿司匹林铜样品的纯度为$\frac{1.860×10{\;}^{-3}×420g}{1.0g}$×100%=78.5%,
)2的物质的量为1.860×10-3 mol,阿司匹林铜样品的纯度为$\frac{1.860×10{\;}^{-3}×420g}{1.0g}$×100%=78.5%,
故答案为:78.5%.
点评 本题以阿司匹林铜的制备为载体考查了实验基本操作、实验原理的分析、化学计算等,是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.


科目:高中化学 来源: 题型:选择题
| A. | 具有氧化性 | B. | 具有还原性 | C. | 具有漂白性 | D. | 含有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂 | B. | 还原剂 | ||
| C. | 既是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | A | B | ||||||
| 3 | C | D | E | F | H | |||
| 4 | G | R |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;已知甲为二元弱酸,写出甲在水中电离出一个H+的电离方程式H2O2?H++HO2-.
;已知甲为二元弱酸,写出甲在水中电离出一个H+的电离方程式H2O2?H++HO2-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com