
可逆反应:aA(g)+bB(s)⇌cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
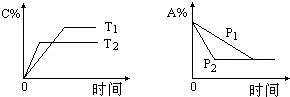
A.T1<T2 △H>0 B.T1>T2 △H<0
C.P1<P2 a=c+d D.P1<P2 a+b=c+d
考点:化学平衡的影响因素;产物的百分含量随浓度、时间的变化曲线.
分析:可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短,由图象可知T2>T1;
当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短,由图象可知p2>p1;
根据温度、压强对化学平衡移动的影响解答该题.
解答: 解:左图中,由“先拐先平数值大”知T2>T1,升高温度,生成物的含量减小,说明平衡向逆反应方向移动,则正反应是放热反应,即△H<0;
右图中,当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短,由图象可知P2>P1,增大压强,反应物B的含量不变,说明平衡不移动,则反应前后混合气体的计量数之和不变,即a=c+d,
故选C.
点评:本题考查化学平衡的图象,根据“先拐先平数值大”确定温度、压强的相对大小,再结合温度、压强对化学平衡的影响来分析解答,难度不大.


科目:高中化学 来源: 题型:
亚硝酸钠(NaNO2)俗称工业盐,外观和食盐相似,有咸味,易溶于水,水溶液显碱性,加强热时能分解产生有刺激性气味的气体,人若误食会引起中毒,致死量为0.3g~0.5g,它使人中毒是因为它能将人体血红蛋白中的Fe2+转化为Fe3+,从而使血红蛋白丧失携氧能力.
(1)以下有关亚硝酸钠的说法正确的是
a.能用紫色石蕊试液测定亚硝酸钠水溶液的酸碱性
b.亚硝酸钠在加强热时分解产生的气体是氨气
c.从使血红蛋白丧失携氧能力的角度看,亚硝酸钠使人中毒的原理与CO相同
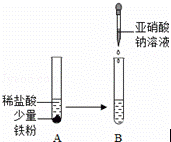
d.利用如图进行实验,B试管中的溶液逐渐变成了黄色
(2)已知NaNO2在酸性条件下能使淀粉碘化钾试纸变蓝,同时生成一种无色气体,遇空气变红棕色.因此可选用淀粉碘化钾试纸和 (生活中常见物质)来鉴别工业盐和食盐.涉及到的反应方程式为 , .
(3)某工厂废切削液中含有2%﹣5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是
a.NaCl b.HNO3 c.NH4Cl d.浓H2SO4
所发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关能量转换的说法正确的是( )
A.铅蓄电池的放电过程是电能转化为化学能
B.化石燃料和植物燃料燃烧时放出的能量是化学能转化为光能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能大部分转变成化学能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
高温下,某反应达到平衡,平衡常数K=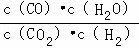 .恒容时,温度升高,H2浓度减小.下列说法正确的是( )
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA
B.14g乙烯、丙烯的混合气体含有C﹣H数为2NA
C.标准状况下,4.48L重水(D2O)中含有的中子数为2NA
D.向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用碳酸钠晶体配制1.00mol•L﹣1的Na2CO3溶液100mL,造成所配溶液浓度偏低的原因是( )
A. 暴露在空气中称量碳酸钠晶体(Na2CO3•10H2O)的时间太长
B. 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C. 定容时俯视刻度线
D. 洗涤液移入容量瓶中时,洒出一部分
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子能大量共存,向溶液中通入足量相应气体后,各离子还能大量存在的是
A、氯气:K+、Ba2+、SiO32-、NO3- B.氨气:K+、Na+、AlO2-、CO32-
C.二氧化硫:Na+、NH4+、SO32-、C1- D.甲醛:Ca2+、Mg2+、MnO4-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com