
【题目】根据下图,下列判断中正确的是( )
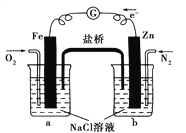
A. 烧杯b中发生还原反应
B. 烧杯b中发生的反应为2Cl--2e-===Cl2↑
C. 烧杯a中发生的反应为2H++2e-===H2↑
D. 烧杯a中的溶液pH升高
科目:高中化学 来源: 题型:
【题目】宋代著名法医学家宋慈 的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2 = 2X+2H2O,下列说法不正确的是( )
A.X的化学式为Ag2S B.银针验毒时,空气中氧气得到电子
C.反应中Ag和H2S均是还原剂 D.每生成1mo1X,反应转移2mo1 e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石棉尾矿主要含有 Mg3(Si2O5)(OH)4 和少量的 Fe2O3、Al2O3。以石棉尾矿为镁源制备碳酸镁晶须(MgCO3nH2O)的工艺如下:

已知“焙烧”过程中的主反应为:Mg3(Si2O5)(OH)4+5(NH4)2SO4![]() 3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑。
3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑。
(1)写出焙烧产物 NH3 的电子式___________。
(2)为提高水浸速率,可采取的措施为________________(任写一条)。“浸渣”的主要成分为_________________。
(3)“除铁、铝”时,需将 pH 调至 8.0 左右,适宜作调节剂的是____(填字母代号)。
a.NaOH b.Mg(OH)2 c.NH3H2O
(4)“沉镁”过程中反应的离子方程式为______________。“沉镁”时若温度超过 60℃,将产生较多的碱式碳酸镁杂质,原因是_______。
(5)流程中可以循环利用的物质是______(填化学式)。

(6)某小组同学称取 13.8 g MgCO3nH2O 进行热重分析,并绘制剩余固体质量随温度变化的曲线如图所示,则 n=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当三个反应中转移的电子个数之比为9:3:8 时,在同温同压下三个反应中所制得氧气体积之比为( )
A.4:3:2 B.9:3:16 C.2:2:1 D.9:3:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2OH++OH-△H>0,下列叙述正确的是( )
A. 向平衡体系中加入水,平衡正向移动,c (H+)增大
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量硫酸氢钠固体, 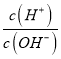 增大
增大
D. 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数值。下列说法正确的是
A. 常温下,Na2O2与N2和CO2组成的混合气体反应生成0.5mol O2时,转移电子数是2NA
B. 标准状况下,11.2 L的甲醇所含的氢原子数等于2NA
C. 电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数目为2 ![]()
D. 1L 1 mol/L CuCl2溶液中含有的氯离子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质形成的晶体,化学键种类和作用方式完全相同的同类型晶体是
A. SO2与SiO2 B. CO2与H2O C. NaCl与Li2O D. CCl4与KCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com