
 CH3OH(g)
CH3OH(g) 

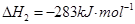

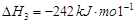
 ��ˮ�������Ȼ�ѧ����ʽΪ ��
��ˮ�������Ȼ�ѧ����ʽΪ �� CH3OH(g)��Ӧ���ʵ��� ��˫ѡ)��
CH3OH(g)��Ӧ���ʵ��� ��˫ѡ)��| A�������CH3OH | B�������¶� | C����Сѹǿ | D��������ʵĴ��� |

 CH3OH(g)��ƽ�ⳣ������д��������̣�
CH3OH(g)��ƽ�ⳣ������д��������̣�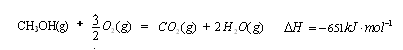 (3��)
(3��) CH3OH(g)
CH3OH(g)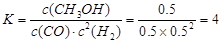 ��2�֣�
��2�֣� �����Է�Ӧ���ǣ�283kJ/mol��242 kJ/mol��2��116 kJ/mol����651 kJ/mol.
�����Է�Ӧ���ǣ�283kJ/mol��242 kJ/mol��2��116 kJ/mol����651 kJ/mol. CH3OH(g)
CH3OH(g)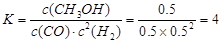


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��NaHSO4��Һ | B��NaOH��Һ | C��KAl(SO4)2��Һ | D��KI��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����һ���¶���AgClˮ��Һ��Ag+��Cl��Ũ�ȵij˻���һ������ |
| B��AgClˮ��Һ�ĵ����Ժ���������AgClΪ������� |
| C���¶�һ��ʱ����AgClˮ��Һ��Ag+��Cl��Ũ�ȵij˻�����KSPֵʱ������ҺΪAgCl�ı�����Һ |
| D����AgClˮ��Һ�м������ᣬc(Cl��)����KSPֵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������������ | B���ܽ��С��CuS��PbS |
| C���ܽ����CuS��PbS��ͬ | D���ܽ�ȴ���CuS��PbS |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.1 mol��L��1�Ĵ�����Һ�м�ˮϡ�ͣ���Һ��c(OH��)��С |
| B��������Һ������Ũ�ȵĹ�ϵ���㣺c(H��)��c(OH��)��c(CH3COO��) |
| C��pH��4�Ĵ�����Һ��pH��10���ռ���Һ�������Ϻ���Һ������ |
| D��������Һ�м�����������ؾ��壬�������̶ȼ�С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ϡ��ǰ����Һ pH���٣��� = �� |
| B��ϡ��ǰ����Һ�����ʵ����ʵ���Ũ�ȣ��ۣ��� =�� |
| C��ϡ�ͺ���Һ pH���٣��� = �� |
| D��ϡ�ͺ���Һ�����ʵ����ʵ���Ũ�ȣ��ۣ��� =�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

A��25��Cʱ������Mg(OH)2��Һ�뱥��MgF2��Һ��ȣ�ǰ�ߵ�c(Mg2+)�� | B��25��Cʱ����Mg(OH)2������Һ����������NH4Cl���壬c(Mg2+)���� | C��25��Cʱ��Mg(OH)2������20ml0.01 mol��L-1��ˮ�е�Ksp����20mL0.01 mol��L-1NH4Cl��Һ�е�KspС | D��25��Cʱ����Mg(OH)2������Һ����NaF��Һ��Mg(OH)2������ת����ΪMgF2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| �������� | Fe(OH)3 | Mg(OH)2 | Al(OH)3 | |
| ��ʼ������pH | 2.3 | 10.8 | 3.7 | ��ʼ�ܽ��pH:7.8 |
| ��ȫ������pH | 4.3 | 12.4 | 5.2 | ��ȫ�ܽ��pH:10.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
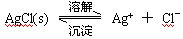
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com