
【题目】下列有关判断的依据正确的是( )
A.电解质:水溶液是否导电
B.原子晶体:构成晶体的微粒是否是原子
C.共价分子:分子中原子间是否全部是共价键
D.化学平衡状态:平衡体系中各组分的物质的量浓度是否相等
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】一定条件下反应A(g)+B(g)C(g)△H<0达到平衡后,据下列图象判断:
达到新的平衡对应的图象 | 平衡移动方向 | |
(i)使用催化剂 | ||
(ii)升温 | ||
(iii)降压 | ||
(iv)增加A的量 | ||
(v)减少C的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是 ( )
A. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
D. 萃取操作时,在选择萃取剂时,要求萃取剂和原溶剂不互溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12,二者可形成DB2、DB3两种分子,DB2具有漂白性.
A | B | |
C | D |
回答下列问题:
(1)A位于元素周期表周期,族,其氢化物的分子式是 .
(2)下列叙述中,正确的是(填字母).
a.稳定性:A的氢化物>C的氢化物 b.还原性:B2﹣>D2﹣
c.酸性:H4CO4>H2DO4 d.最高化合价值:D=B>A>C
(3)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2 . 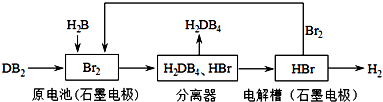
①原电池中DB2参与反应的电极为 , 写出电极反应式;若有5mol DB2参加反应(假若反应物无损耗),则生成标准状况下L H2 .
②为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到 , 证明分离效果较好.
③将该工艺流程用总反应的化学方程式表示为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应。若生成硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐的物质的量浓度之比为( )
A. 1:2:3 B. 1:6:9 C. 1:3:3 D. 1:3:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有碳酸钠和碳酸氢钠的固体混合物,先取m g固体样品进行加热,完全分解产生CO2气体112 mL;另取m g固体样品溶于水,加入足量的盐酸时产生CO2 448 mL(气体体积均为标准状况下测定)。
(1)求m g混合物中碳酸氢钠与碳酸钠的物质的量各是多少?_________
(2)若产生448 mL CO2时,消耗盐酸的体积为300mL,则该盐酸的物质的量浓度是多少?____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取一氯乙烷(CH3CH2Cl)应采用( )
A. 由乙烯和氯气在一定条件下发生加成反应
B. 由乙烯和氯化氢在一定条件下发生加成反应
C. 由乙烷和氯气在一定条件下发生取代反应
D. 由乙烷和氯气在一定条件下发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g)3Z(g),平衡时,X,Y,Z的体积分数分别为30%、60%、10%,在此平衡体系中加入1molZ(g),再将达到平衡后,X,Y,Z的体积分数不变.下列叙述不正确的是( )
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com