
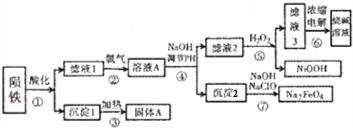
分析 陨铁用酸溶解,硅酸钠反应得到难溶的硅酸,沉淀1为硅酸,过滤分离,硅酸加热分解得到A为二氧化硅,滤液1中含有硫酸亚铁、硫酸铁、硫酸镍、未反应的硫酸等,通入氯气将Fe2+离子氧化为Fe3+,加入NaOH调节溶液pH使Fe3+使转化为Fe(OH)3沉淀,氢氧化铁与氢氧化钠、次氯酸钠反应得到Na2FeO4.滤液2中加入过氧化氢,滤液3中含有钠盐及氢氧化钠,浓度电解得到烧碱溶液.
(1)最终电解滤液3得烧碱溶液,用盐酸酸化陨石;固体A为二氧化硅,可以用作光导纤维;
(2)用酸性高锰酸钾溶液或铁氰化钾溶液检验亚铁离子;
(3)在第④步加NaOH调节溶液pH,使Fe3+使转化为Fe(OH)3沉淀,而Ni2+不能沉淀;
(4)第⑤步是过氧化氢在碱性条件下将Ni2+氧化生成NiOOH;
第⑦步是氢氧化铁与氢氧化钠、次氯酸钠反应得到Na2FeO4,次氯酸钠被还原为氯化钠;
(5)第⑥步中电解得到氯气、氢氧化钠可以循环利用.
解答 解:陨铁用酸溶解,硅酸钠反应得到难溶的硅酸,沉淀1为硅酸,过滤分离,硅酸加热分解得到A为二氧化硅,滤液1中含有硫酸亚铁、硫酸铁、硫酸镍、未反应的硫酸等,通入氯气将Fe2+离子氧化为Fe3+,加入NaOH调节溶液pH使Fe3+使转化为Fe(OH)3沉淀,氢氧化铁与氢氧化钠、次氯酸钠反应得到Na2FeO4.滤液2中加入过氧化氢,滤液3中含有钠盐及氢氧化钠,浓度电解得到烧碱溶液.
(1)最终电解滤液3得烧碱溶液,用盐酸酸化陨石;固体A为二氧化硅,可以用作光导纤维,
故答案为:盐酸;光导纤维;
(2)用酸性高锰酸钾溶液或铁氰化钾溶液检验亚铁离子,
故答案为:酸性高锰酸钾溶液或铁氰化钾溶液;
(3)在第④步加NaOH调节溶液pH,使Fe3+使转化为Fe(OH)3沉淀,而Ni2+不能沉淀,调节溶液pH的范围应为:3.7≤pH<8.5,
故答案为:3.7≤pH<8.5;
(4)第⑤步是过氧化氢在碱性条件下将Ni2+氧化生成NiOOH,反应离子方程式为:2Ni2++H2O2+4OH-=2NiOOH+2H2O,
第⑦步是氢氧化铁与氢氧化钠、次氯酸钠反应得到Na2FeO4,次氯酸钠被还原为氯化钠,反应离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Ni2++H2O2+4OH-=2NiOOH+2H2O;2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
(5)第⑥步中电解得到氯气、氢氧化钠分别在第②中的氧化,第④调节pH中循环利用,
故答案为:NaOH、Cl2.
点评 本题考查物质制备工艺流程,涉及对条件控制选择、离子检验、陌生方程式书写等,关键是对工艺流程的理解,侧重考查学生分析能力、知识迁移运用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 由非电解质溶于水得到的溶液 | |
| B. | 将pH=9的烧碱溶液稀释100倍所得到的溶液 | |
| C. | 等物质的量的强酸与强碱反应得到的溶液 | |
| D. | c(H+)、c(OH-)均为5.0×10-7mol•L-1的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、苯、乙醇均能使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯和聚丙烯都能与氢气在一定条件下发生加成反应 | |
| C. | 煤制煤气是化学变化,是高效、清洁地利用煤的重要途径 | |
| D. | 乙酸乙酯、油脂、葡萄糖、蛋白质都可以发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硝基苯是一种重要的化工原料,其制备原理是:
硝基苯是一种重要的化工原料,其制备原理是: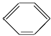 +HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$
+HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$ 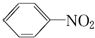 +H2O△H<0
+H2O△H<0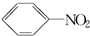 +HO-NO2$→_{△}^{H_{2}SO_{4}}$
+HO-NO2$→_{△}^{H_{2}SO_{4}}$ 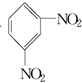 +H2O
+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
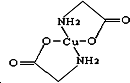 Cu及其化合物在科学研究和工业生产中具有许多用途.请回答以下问题:
Cu及其化合物在科学研究和工业生产中具有许多用途.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaNO3溶液 | B. | 加入少量CuSO4溶液 | ||
| C. | 加入少量蒸馏水 | D. | 改用98%的浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com