
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1=25% | α2 | α3 |
分析 (1)由以上数据,甲、乙是等效平衡,丙是乙的2倍,则达平衡时,N2的浓度丙大于乙,根据甲中以H2表示的反应速率=$\frac{△c}{△t}$计算;
(2)温度不变,则平衡常数不变,所以丙中反应2NH3?N2+3H2的平衡常数为甲的倒数;
(3)甲投入1molN2、3molH2,乙中投入2molNH3,则甲与乙是完全等效的,根据盖斯定律可知,甲与乙的反应的能量变化之和为92.4kJ,故a+b=92.4;
丙容器反应物投入量4molNH3,是乙的二倍,若平衡不移动,转化率α1+α3=1;由于丙中相当于增大压强,平衡向着向着正向移动,氨气的转化率减小,所以转化率α1+α3<1;
(4)A.使用催化剂,平衡不移动;
B.增大氮气浓度,所以平衡正向移动,但氮气浓度增大,则平衡后$\frac{c(N{H}_{3})}{c({N}_{2})}$比值变小;
C.升高温度平衡向逆反应方向移动;
D.缩小容器体积增大压强,平衡正向移动.
解答 解:(1)由以上数据,甲、乙是等效平衡,所以N2的浓度相等,丙是乙的2倍,则达平衡时,N2的浓度丙大于乙,从反应开始到达到平衡,甲中以H2表示的反应速率=$\frac{△c}{△t}$=$\frac{\frac{3×25%}{1}}{1}$=0.75 mol/(L•min),故答案为:甲=乙<丙;0.75 mol/(L•min);
(2)已知甲中合成氨反应,则N2(g)+3H2(g)?2NH3(g)
起始量(mol) 1 3 0
变化量(mol) 0.25 0.75 0.5
平衡量(mol) 0.75 2.25 0.5
该反应的平衡常数K=$\frac{c(NH{\;}_{3}){\;}^{2}}{c(N{\;}_{2})c(H{\;}_{2}){\;}^{3}}$=$\frac{0.5{\;}^{2}}{0.75×2.25{\;}^{3}}$,
又温度不变,则平衡常数不变,所以丙中反应2NH3?N2+3H2的平衡常数=$\frac{1}{K}$=34.17,故答案为:34.17;
(3)甲投入1molN2、3molH2,乙中投入2molNH3,则甲与乙是完全等效的,根据盖斯定律可知,甲与乙的反应的能量变化之和为92.4kJ,故a+b=92.4;
丙容器反应物投入量4molNH3,是乙的二倍,若平衡不移动,转化率α1+α3=1;由于丙中相当于增大压强,平衡向着向着正向移动,氨气的转化率减小,所以转化率α1+α3<1;
故答案为:=;<;
(4)A.使用催化剂,平衡不移动,平衡后$\frac{c(N{H}_{3})}{c({N}_{2})}$比值不变,故错误;
B.增大氮气浓度,所以平衡正向移动,但氮气浓度增大,则平衡后$\frac{c(N{H}_{3})}{c({N}_{2})}$比值变小,故正确;
C.升高温度平衡向逆反应方向移动,则平衡后$\frac{c(N{H}_{3})}{c({N}_{2})}$比值变小,故正确;
D.缩小容器体积增大压强,平衡正向移动,平衡后$\frac{c(N{H}_{3})}{c({N}_{2})}$比值增大,故错误;
故选:BC.
点评 本题考查化学平衡影响因素、等效平衡、化学平衡的计算,题目计算量较大,题目难度较大,关键是构建平衡建立的等效途径,试题侧重对学生灵活运用基础知识解决实际问题的能力的培养.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.3mol H2和0.7mol O2混合气体总体积约为22.4L | |
| B. | 非标准状况下,1mol气体的体积也可能约为22.4L | |
| C. | 标准状况下,22.4L任何气体中都约含有6.02×1023个分子 | |
| D. | 标准状况下,某物体含有6.02×1023个粒子,那么此物质所占的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的系统命名2-甲基-3-乙基己烷
的系统命名2-甲基-3-乙基己烷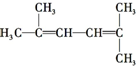
 的键线式:
的键线式:
 中,共平面的碳原子最多有13个,该分子中有4种不同化学环境的H原子.
中,共平面的碳原子最多有13个,该分子中有4种不同化学环境的H原子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
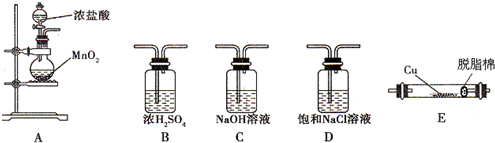
 ;若在标准状态下收集到2.24L氯气,则被氧化的HCl的物质的量是0.2mol.
;若在标准状态下收集到2.24L氯气,则被氧化的HCl的物质的量是0.2mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 从“南澳一号”沉船中发现了大量宋代精美瓷器,体现了灿烂的中华文明.青花瓷胎体的原料--高岭土[Al2Si2O5(OH)x]可掺进瓷石制胎,青花瓷釉料的成分主要是钾长石(KAlSi3O8),在1 300℃左右一次烧成的釉可形成精美的青花瓷.
从“南澳一号”沉船中发现了大量宋代精美瓷器,体现了灿烂的中华文明.青花瓷胎体的原料--高岭土[Al2Si2O5(OH)x]可掺进瓷石制胎,青花瓷釉料的成分主要是钾长石(KAlSi3O8),在1 300℃左右一次烧成的釉可形成精美的青花瓷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0 kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g);△H12C(s)+O2(g)=2CO(g);△H2,则△H1>△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com