
| A. | 除去CO2中少量O2:用点燃的方法 | |
| B. | 除去NaCl溶液中的Na2SO4:加入适量Ba(NO3)2溶液后,过滤 | |
| C. | 除去Cu中的少量Fe:加入足量稀硫酸溶液后,过滤,洗涤,干燥 | |
| D. | 除去CO2中的少量HCl:通入NaOH溶液后,收集气体 |
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③④ | C. | ②③④⑥ | D. | ①②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | K2SO4 | B. | NaOH | C. | NaCl | D. | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 方案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气中燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别放入热浓硫酸中 | 产物分别为Fe2(SO4)3和CuSO4 |
| ④将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡,铜片上不产生气泡 |
| ⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | R | W | X | Y | Z | 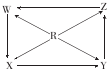 |
| A | Si | SiO2 | H2SiO2 | Na2SiO2 | SiCl4 | |
| B | Na | Na2O | Na2O2 | Na2CO3 | NaOH | |
| C | Fe | Fe(OH)2 | FeCl3 | FeCl3 | Fe(NO4)3 | |
| D | Al | NaAlO2 | Al2(SO4)3 | AlCl3 | Al(NO4)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 检验Fe(NO3)2晶体是否已氧化变质,将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 | |
| D. | 常温下将Al片放入浓硝酸中,无明显变化,所以Al与浓硝酸不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com