
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;?
③B、D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;?
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和。?
请填写下列空白:?
(1)D2C2的电子式 。?
(2)1 mol E单质与足量乙的溶液反应,能生产 mol A2气体。并写出其反应的离子方程式 。
(3)写出下列溶液反应的离子方程式:?
乙+丙: 。?
(4)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为 。?
(5)以石墨为电极,电解乙的溶液400 mL,当电路中通过a mol电子时,阴、阳两极共产生气体 L(标准状况),溶液中c (OH-) (填“增大”“减小”或“不变”)。
(1)?![]()
(2)1.5 2Al+2OH-+2H2O![]() 2AlO
2AlO![]() +3H2↑?
+3H2↑?
(3)Al(OH)3+OH-![]() AlO
AlO![]() +2H2O?
+2H2O?
![]()
(5)
解析:A、B、C、D、E为短周期,可知为前18号元素,A是所有元素中半径最小的元素,一定为氢,A、D同主族且D在五种元素中半径最大,所以是钠不是锂。B、D、E三者水化物两两反应,可知,一定有两性金属氢氧化物Al(OH)3,盐中都含C,盐都是含氧酸盐和偏铝酸盐,所以都含氧,C为氧,B的序数小于氧,最高价氧化物对应水化物为强酸,为氮,E为铝。?
A、B、C、D、E分别为H、N、O、Na、Al,甲、乙、丙分别为HNO3、NaOH、Al(OH)3。?
(1)Na2O2电子式为![]() ?
?
(2)1 mol Al与足量NaOH溶液反应,离子方程式:2Al+2OH-+2H2O![]() AlO
AlO![]() +3H2↑?
+3H2↑?
1 mol Al~1.5 mol H2。?
(3)NaOH与Al(OH)3反应离子方程式:Al(OH)3+OH-![]() AlO
AlO![]() +2H2O?
+2H2O?
(4)NH3和NO反应生成物无毒,由氧化还原规律-3和+3可归中为0,N2,
4NH3+6NO![]() 5N2+6H2O?
5N2+6H2O?
(5)电解NaOH溶液本质是电解H2O?
2H2O![]() 2H2+O2↑ n(e-)?
2H2+O2↑ n(e-)?
2 mol 1 mol?
3 mol 4 mol?
n(g) a mol?
n(g)=![]() a mol
a mol
V (g)=![]() a mol×
a mol×


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:阅读理解
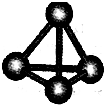 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.

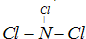
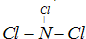
查看答案和解析>>
科目:高中化学 来源: 题型:


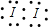
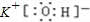
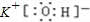
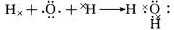
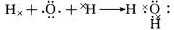
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| D的单质 |
| D的单质 |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com