
分析 根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$结合物质的组成分析解答.
解答 解:A、6g H2的物质的量为$\frac{m}{M}$=$\frac{6g}{2g/mol}$=3mol,所含有分子数为3NA,原子数为6NA;
B、0.5mol CO2所含有分子数为0.5NA,原子数为1.5NA,其质量为m=nM=0.5mol×44g/mol=22g;
C、1.204×1024 个HCl 分子的物质的量为$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}}$=2mol,所含有分子数为2NA,原子数为4NA,其质量为2mol×36.5g/mol=73g
D、147g H2SO4的物质的量为=$\frac{147g}{98g/mol}$=1.5mol,所含有分子数为1.5NA,原子数为10.5NA;
E、92g C2H5OH(乙醇)的物质的量为=$\frac{92g}{46g/mol}$=2mol,所含有分子数为2NA,原子数为18NA;
所以物质的量最大的是H2,含分子个数最多的是H2;含原子个数最多的是C2H5OH,质量最大的是H2SO4.
故答案为:H2;H2;C2H5OH;H2SO4.
点评 本题考查物质的量的相关计算,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用以及物质的构成特点,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 NaHCO3溶液与0.1 mol•L-1 NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO32-)>c(OH-) | |
| B. | 20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol•L-1 CH3COOH溶液与0.1 mol•L-1 NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2能与金属反应,生成高价金属盐 | |
| B. | 新制的氯水中加入AgNO3溶液,有白色沉淀生成 | |
| C. | 欲除去CO2中的大量HCl气体,可将此混合气体通过盛有饱和NaHCO3溶液的洗气瓶 | |
| D. | 漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠块浮在液面上,四处游走 | |
| B. | 钠块熔化成小球,逐渐减小最后消失 | |
| C. | 产生蓝色沉淀且出现暗斑 | |
| D. | 烧杯底部析出暗红色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L四氯化碳所含分子的数目为0.5NA | |
| B. | 87g MnO2与4mol浓盐酸共热完全反应,能得到Cl2分子的数目为NA | |
| C. | 1mol Na2O2与足量CO2或水反应时,转移电子的数目为NA | |
| D. | 1mol/L的NaOH溶液中含Na+数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
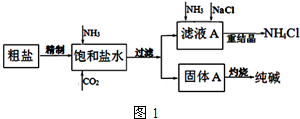 纯碱(Na2CO3)在生产生活中具有广泛的用途.如图1是实验室模拟制碱原理制取Na2CO3的流程图.
纯碱(Na2CO3)在生产生活中具有广泛的用途.如图1是实验室模拟制碱原理制取Na2CO3的流程图.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com