
| A. | 按系统命名法 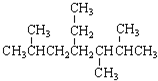 ,的名称为2,5,6-三甲基-4-乙基庚烷 ,的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖 | |
| D. | 苯酚为无色晶体,常因为氧化呈粉红色 |
分析 A.未满足取代基位次之和最小,主链编号错误;
B.烷烃同分异构体中支链越多,沸点越低;
C.蔗糖水解后的产物葡萄糖有还原性,自身没有还原性;
D.苯酚在空气中容易被氧化,呈粉红色;
解答 解:A.主链含有7个碳为庚烷,从右端编号,化合物的名称应是2,3,5-三甲基-4-乙基庚烷,故A错误;
B.烷烃同分异构体中支链越多,沸点越低,则正戊烷、异戊烷、新戊烷的沸点依次降低,故B错误;
C.蔗糖水解后的产物葡萄糖有还原性,自身没有还原性,所以不是还原型二糖,故C错误;
D.苯酚暴露在空气中容易被氧化,所以呈粉红色,故D正确;
故选D.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质,为解答该类题目的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 气体摩尔体积为22.4 L•mol-1 | |
| B. | 1 mol O2的质量是32 g,它所占的体积是22.4 L | |
| C. | 标准状况下,1 mol任何物质的体积均约为22.4 L | |
| D. | 标准状况下,6.02×1023个CO分子的体积约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
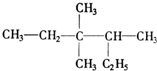 3,3,4-三甲基己烷;
3,3,4-三甲基己烷;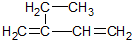 2-乙基-1,3-丁二烯.
2-乙基-1,3-丁二烯.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
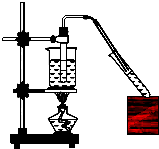 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液酸性越强,R 的降解速率越小 | |
| B. | R的起始浓度越小,降解速率越大 | |
| C. | 在0~50 min之间,pH=2和PH=7时R的降解百分率相等 | |
| D. | 在20~25 min之间,pH=10 时R的平均降解速率为0.04 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V3>V2>V1 | B. | V3=V2>V1 | C. | V3>V2=V1 | D. | V1=V2>V3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 4个 | C. | 5个 | D. | 7个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
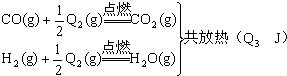
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com