
| A. | CH4和NH4+ | B. | B3H6N3和C6H6 | C. | CO2、N2O | D. | H2O和CH4 |
分析 原子数相同、电子数(或价电子总数)相同的物质称为等电子体,据此概念判断选择即可.
解答 解:A、CH4和NH4+的电子数分别为6+4=10和7+4-1=10,原子数均为5,属于等电子体,故A正确;
B、B3H6N3和C6H6的电子数分别为:5×3+6+3×7=42和6×6+6=42,原子数分别为3+6+3=12和6+6=12,属于等电子体,故B正确;
C、CO2、N2O电子数分别为:6+16=22和14+8=22,原子数均为3,属于等电子体,故C正确;
D、H2O和CH4的原子总数不相同,不是等电子体,故D错误,
故选D.
点评 本题考查等电子体的概念与判断,难度中等,注意原子数相同、电子数(或价电子总数)相同的物质称为等电子体.


科目:高中化学 来源: 题型:解答题
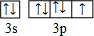 ,R基态原子的外围电子排布式为3d104s1.
,R基态原子的外围电子排布式为3d104s1.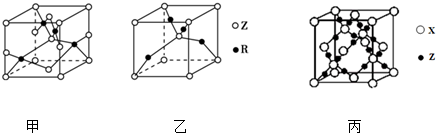
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
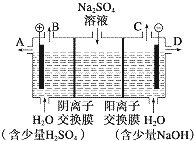 某课外活动小组设想:如果模拟工业上离子交换膜法制烧碱的方法,利用如图实验装置(两电极均为石墨电极)电解Na2SO4溶液来制取H2、O2、H2SO4和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
某课外活动小组设想:如果模拟工业上离子交换膜法制烧碱的方法,利用如图实验装置(两电极均为石墨电极)电解Na2SO4溶液来制取H2、O2、H2SO4和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:Na>Mg>Ca | B. | 氧化性:Cl2>S>P | ||
| C. | 酸性:H2SO4>H3PO4>HClO4 | D. | 稳定性:PH3>H2S>HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸收能量92kJ | B. | 放出能量92kJ | C. | 放出能量30.67kJ | D. | 吸收能量30.67kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com