
分析 (1)①Fe(s)+$\frac{1}{2}$O2(g)=FeO(s)△H=-272.0kJ•mol-1
②2Al(s)+$\frac{3}{2}$O2(g)=Al2O3(s)△H=-1675.7kJ•mol-1
由盖斯定律可知,②-①×3得到3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s);
(2)①K1000℃<K1200℃,可知升高温度平衡正向移动;
②Na2S水解显碱性;
(3)充电时阳极发生氧化反应,失去电子;电解1L 1mol•L-1的CuSO4溶液,发生2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+2Cu+O2↑~4e-,当转移0.1mol 电子时,生成硫酸为0.05mol;
(4)①等体积等浓度混合生成NaA,混合液的pH=8,可知水解显碱性,水解促进水的电离,NaOH抑制水的电离;
②HA溶液加到Na2CO3溶液中有气体放出,则HA酸性大于碳酸,(NH4)2CO3溶液水解显碱性;酸性越强pH越小,以此来解答.
解答 解:(1)①Fe(s)+$\frac{1}{2}$O2(g)=FeO(s)△H=-272.0kJ•mol-1
②2Al(s)+$\frac{3}{2}$O2(g)=Al2O3(s)△H=-1675.7kJ•mol-1
由盖斯定律可知,②-①×3得到3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7kJ.mol-1,
则Al和FeO发生铝热反应的热化学方程式是3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7kJ.mol-1,
故答案为:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7kJ.mol-1;
(2)①K1000℃<K1200℃,可知升高温度平衡正向移动,则正反应为吸热反应,故答案为:吸热;
②Na2S水解显碱性,发生离子反应为S2-+H2O?HS-+OH-,故答案为:S2-+H2O?HS-+OH-;
(3)充电时阳极发生氧化反应,失去电子,则阳极反应为VO2++H2O-e-═VO2++2H+;电解1L 1mol•L-1的CuSO4溶液,发生2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+2Cu+O2↑~4e-,当转移0.1mol 电子时,生成硫酸为0.05mol,氢离子浓度为$\frac{0.05mol×2}{1L}$=0.1mol/L,pH=1,
故答案为:VO2++H2O-e-═VO2++2H+;1;
(4)①等体积等浓度混合生成NaA,混合液的pH=8,可知水解显碱性,水解促进水的电离,NaOH抑制水的电离,则混合溶液中水电离出的c(H+)>0.1mol•L-1NaOH溶液中水电离出的c(H+),
故答案为:>;
②HA溶液加到Na2CO3溶液中有气体放出,则HA酸性大于碳酸,(NH4)2CO3溶液水解显碱性,(NH4)2CO3溶液的pH>7;酸性越强pH越小,NH4HCO3、(NH4)2CO3的pH>7,但碳酸根离子水解程度大,NH4A的pH=7,NH4Cl的pH<7,pH由大到小的顺序为c>a>b>d,
故答案为:>;c>a>b>d.
点评 本题考查较综合,涉及反应热与焓变、平衡常数与平衡移动、电化学、酸碱混合等,为高频考点,把握盖斯定律应用、温度对K的影响、电极反应、盐类水解为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
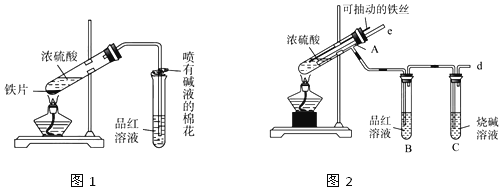
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲基(CH3-)所含的电子数分别为10NA | |
| B. | 标准状况下,22.4 L四氯化碳中含有C-Cl键的数目为4NA | |
| C. | 常温常压下,1 mol分子式为C2H6O的有机物中,含有C-O键的数目为NA | |
| D. | 46g 由NO2和N2O4组成的混合气体中,含有的原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
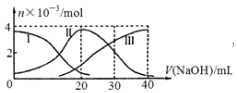 手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,如图是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,下列说法正确的是( )
手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,如图是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,下列说法正确的是( )| A. | H2A在水中的电离方程式是:H2A═2H++A2- | |
| B. | 当V(NaOH)=40mL时,其溶液中水的电离受到抑制 | |
| C. | 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 当V(NaOH)=30mL时,则有:c(H+)+c(Na+)═c(A2-)+c(OH-)+c(HA-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| A | B | C | D | |
| 装置甲中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 白色沉淀 | ----- | ------ |
| 装置乙中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 有气泡 | 有气泡 | 品红褪色 |

| 步骤I | 往5mL1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤II | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
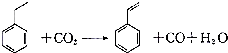 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 苯乙烯分子中含有4个碳碳双键 | B. | 苯乙烯分子式为C8H10 | ||
| C. | 乙苯有三种同分异构体 | D. | 乙苯能发生取代、加成和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
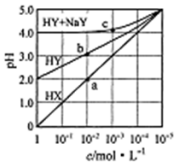 常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )
常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )| A. | HX是强酸,溶液每稀释10倍,pH始终增大1 | |
| B. | 常温下HY的电离常数为1.0×10-4 | |
| C. | 溶液中水的电离程度:a点大于b点 | |
| D. | c 点溶液中:c(Na+)>c(Y-)>c(HY)c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
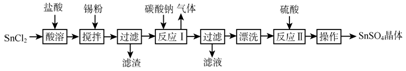
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com