
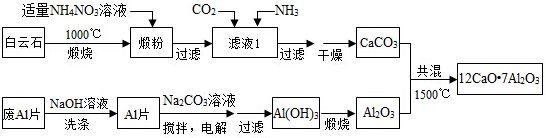
分析 白云石煅烧发生反应:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,MgCO3$\frac{\underline{\;高温\;}}{\;}$MgO+CO2↑,在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3•H2O,故过滤后溶液中含Ca(NO3)2和NH3•H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,据此分析滤液中的阴离子;若滤液Ⅰ中仅通入CO2,会造成CO2过量,废铝片加入氢氧化钠溶液反应生成偏铝酸钠溶液,用NaOH溶液可除去废Al片表面的氧化膜,电解制备Al(OH)3时,电极分别为Al片和石墨,在碳酸钠溶液中搅拌电解,得到氢氧化铝,过滤加热灼烧得到氧化铝,碳酸钙和氧化铝共混加热1500°C得到七铝十二钙,
(1)锻粉是由白云石高温煅烧而来;用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,即得Mg(OH)2的饱和溶液,根据Mg(OH)2的Ksp来计算;CaSO4微溶于水;
(2)在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3•H2O,故过滤后溶液中含Ca(NO3)2和NH3•H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,据此分析滤液中的阴离子;若滤液Ⅰ中仅通入CO2,会造成CO2过量,据此分析产物;
(3)氧化铝和氢氧化钠反应生成偏铝酸钠和水;
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,铝被氧化生成氢氧化铝,阴极生成氢气;
(5)放电时负极电极本身Al放电,失电子,根据AlCl4-和Al2Cl7-中铝元素和氯元素的比例来确定做AlCl4-做反应物而生成Al2Cl7-.
解答 解:白云石煅烧发生反应:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,MgCO3$\frac{\underline{\;高温\;}}{\;}$MgO+CO2↑,在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3•H2O,故过滤后溶液中含Ca(NO3)2和NH3•H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,据此分析滤液中的阴离子;若滤液Ⅰ中仅通入CO2,会造成CO2过量,废铝片加入氢氧化钠溶液反应生成偏铝酸钠溶液,用NaOH溶液可除去废Al片表面的氧化膜,电解制备Al(OH)3时,电极分别为Al片和石墨,在碳酸钠溶液中搅拌电解,得到氢氧化铝,过滤加热灼烧得到氧化铝,碳酸钙和氧化铝共混加热1500°C得到七铝十二钙,
(1)锻粉是由白云石高温煅烧而来,在煅烧白云石时,发生反应:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,MgCO3$\frac{\underline{\;高温\;}}{\;}$MgO+CO2↑,故所得锻粉主要含MgO和CaO;用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,即得Mg(OH)2的饱和溶液,根据Mg(OH)2的Ksp可知:Ksp=c(Mg2+)•c2(OH-)=5×10-12,而c(Mg2+)小于5×10-6mol•L-1,故c(OH-)大于10-3mol/L,则溶液中的c(H+)小于10-11mol/L,溶液的pH大于11;CaSO4微溶于水,如果用(NH4)2SO4代替NH4NO3,会生成CaSO4沉淀引起Ca2+的损失,
故答案为:CaO;11;CaSO4微溶于水,用(NH4)2SO4代替NH4NO3,会生成CaSO4沉淀引起Ca2+的损失;
(2)在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3•H2O,故过滤后溶液中含Ca(NO3)2和NH3•H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,故滤液中的阴离子主要为NO3-,还含有OH-;若滤液Ⅰ中仅通入CO2,会造成CO2过量,则会生成Ca(HCO3)2,从而导致CaCO3产率降低,
故答案为:NO3-、OH-;Ca(HCO3)2;
(3)氧化铝和氢氧化钠反应生成偏铝酸钠和水,离子反应为Al2O3+2OH-═2AlO2-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O;
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,铝被氧化生成氢氧化铝,阴极生成氢气,电解总反应方程式为2Al+6H2O$\frac{\underline{\;电解\;}}{\;}$2Al(OH)3↓+3H2↑,
故答案为:2Al+6H2O$\frac{\underline{\;电解\;}}{\;}$2Al(OH)3↓+3H2↑;
(5)放电时负极电极本身Al放电,失电子,由于AlCl4-中氯元素的含量高于Al2Cl7-中氯元素的含量,故AlCl4-做反应物而Al2Cl7-为生成物,由于其它离子不参与电极反应,故电极反应为:Al-3e-+7AlCl4-=4Al2Cl7-,
故答案为:Al-3e-+7AlCl4-=4Al2Cl7-.
点评 本题综合考查物质的制备以及分离提纯、电解池和原电池的知识考查,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及题给信息,题目难度中等.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,比钒质子数大1的元素原子的电子排布式为1s22s22p63s23p63d54s1.
,比钒质子数大1的元素原子的电子排布式为1s22s22p63s23p63d54s1.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeS+浓HNO3 | B. | Cu+浓HNO3 | C. | FeO+HNO3 | D. | Fe2O3+HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验 方案 | 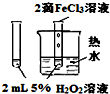 | 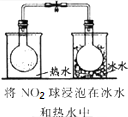 | 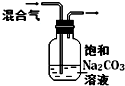 | 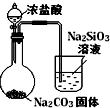 |
| 实验 目的 | 验证FeCl3对H2O2分解反应有催化作用 | 探究温度对平衡2NO2→N2O4的影响 | 除去CO2气体中混有的SO2 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 油脂是人体需要的重要的营养成分,属于天然高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com