



 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
| A、原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 |
| B、Fe3+的最外层电子排布式为3s23p63d5 |
C、基态铜原子的最外层的电子排布图: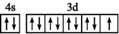 |
| D、所有非金属元素都分布在p区 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、燃放鞭炮 | B、配制生理盐水 |
| C、食物腐烂 | D、湿法炼铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①②④ |
| C、②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )| A、⑥、⑧、⑨对应原子的半径依次减小 |
| B、②、⑦的最高价氧化物对应的水化物能相互反应 |
| C、元素⑩为Fe元素,处于常见周期表第四周期第VIIIB族 |
| D、①可分别与③、④、⑤均可形成既含极性键又含非极性键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将氢氧化钠、氯化钡和硫酸铝三种固体组成的混合物溶于足量的水中,充分溶解,用1mol?L-1稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断正确的是( )
将氢氧化钠、氯化钡和硫酸铝三种固体组成的混合物溶于足量的水中,充分溶解,用1mol?L-1稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断正确的是( )| A、A点所表示的沉淀是:Al(OH)3、BaSO4 |
| B、B-C段所发生反应的离子方程式是:H++OH-→H2O |
| C、A-B段发生反应的离子方程式:Ba2++SO42-→BaSO4↓ |
| D、拐点E的横坐标为70mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其原子最外电子层只1个电子的元素 |
| B、最低负化合价为-3价的元素 |
| C、其原子最外层电子数大于电子层数的元素 |
| D、最高价氧化物对应的水化物是酸的元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com