
【题目】钴被誉为战略物资,有出色的性能和广泛的应用。以水钴矿(主要成分为Co2O3、CoO、CuO、Fe2O3、CaO、MgO、NiO和SiO2等)为原料制备CoCl2·6H2O的工艺流程如图所示:

回答下列问题:
(1)“酸浸”
①钴的浸出率随酸浸时间、温度的变化关系如下图所示。综合考虑成本,应选择的最佳工艺条件为_________________;滤渣A的主要成分为__________。

②写出Co2O3与浓硫酸反应生成CoSO4的化学方程式___________________________。
(2)“净化除杂”过程包括除铁、除钙镁、除铜等步骤。
①除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12,写出反应的离子方程式____________________________________。
②除铜:加入适量Na2S2O3,发生反应2CuSO4+2Na2S2O3+2H2O=Cu2S↓+S↓+2Na2SO4+2H2SO4,Na2S2O3中硫元素的化合价是___________,上述反应每消耗15.8 g Na2S2O3,反应中转移电子___________mol。
(3)“萃取和反萃取”
①“水相C”中的溶质主要是Na2SO4和________(写化学式)。
②实验室称取100g原料(含钴11.80%),反萃取时得到浓度为0.036mol·L-1的CoCl2溶液5L,忽略损耗,钴的产率=____________(产率= )。
)。
【答案】12h,90℃SiO2(二氧化硅)2Co2O3+4H2SO4(浓)![]() 4CoSO4+4H2O+O2↑2Na++6Fe3++4SO42-+12H2O
4CoSO4+4H2O+O2↑2Na++6Fe3++4SO42-+12H2O![]() Na2Fe6(SO4)4(OH)12↓+12H++20.4NiSO490%
Na2Fe6(SO4)4(OH)12↓+12H++20.4NiSO490%
【解析】
(1)①结合题给图像和钴的浸出率来看,综合考虑成本,应选择的最佳工艺条件为12h,90℃;水钴矿主要成分中除SiO2在酸浸过程中不能溶解,所以滤渣A的主要成分为SiO2(二氧化硅);
②Co2O3与浓硫酸反应生成CoSO4,可知Co2O3作氧化剂,而硫酸中的H、S都处于最高价,故Co2O3只能氧化硫酸中的氧元素生成O2,根据电子守恒可以写出该反应的化学方程式为2Co2O3+4H2SO4(浓)![]() 4CoSO4+4H2O+O2↑,
4CoSO4+4H2O+O2↑,
因此,本题中确答案为:12h,90℃;SiO2(二氧化硅);2Co2O3+4H2SO4(浓)![]() 4CoSO4+4H2O+O2↑;
4CoSO4+4H2O+O2↑;
(2)①加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12,根据原子守恒可写出反应的离子方程式为2Na++6Fe3++4SO42-+12H2O![]() Na2Fe6(SO4)4(OH)12↓+12H+;
Na2Fe6(SO4)4(OH)12↓+12H+;
②加入适量Na2S2O3,发生反应2CuSO4+2Na2S2O3+2H2O=Cu2S↓+S↓+2Na2SO4+2H2SO4,Na2S2O3中硫元素的化合价是+2,化合价降低的是铜从+2价降到-1价,Na2S2O3中有一部分S化合价从+2价降到-2价或0价,有一部分从+2价升高到+6价(生成H2SO4),每消耗2molNa2S2O3,反应中转移电子(6-2)![]() 2mol=8mol,则每消耗15.8 g Na2S2O3,反应中转移电子
2mol=8mol,则每消耗15.8 g Na2S2O3,反应中转移电子![]() ×8=0.4mol,
×8=0.4mol,
因此,本题中确答案为:2Na++6Fe3++4SO42-+12H2O![]() Na2Fe6(SO4)4(OH)12↓+12H+ ;+2;0.4;
Na2Fe6(SO4)4(OH)12↓+12H+ ;+2;0.4;
(3)①纵览整个流程可知,经过了酸浸以后,过滤,得到的滤液经历了除铁、除钙和镁、除铜以后,在经过萃取操作,“水相C”中的主要溶质只剩下Na2SO4和NiSO4;
②实验室称取100g原料(含钴11.80%),反萃取时得到浓度为0.036mol·L-1的CoCl2溶液5L,忽略损耗,则钴的产率=![]() ×100%=90%。
×100%=90%。
因此,本题中确答案为:NiSO4 ;90%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用如下图装置实验,下列实验现象预期及相应结论均正确的是
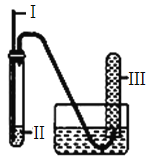
选项 | Ⅰ | Ⅱ | 实验现象预期 | 结论 |
A | 铁丝 | HCl酸化的H2O2 | Ⅲ中收集到无色气体 | 铁丝催化H2O2分解 |
B | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
C | 木条 | 浓硫酸 | 木条变黑 | 浓硫酸有强氧化性 |
D | 铜丝 | 浓硝酸 | Ⅲ中收集到红棕色气体 | 硝酸有强氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向2L恒容密闭容器中充入1molCOCl2(g)发生反应:COCl2(g)![]() Cl2(g)+CO(g),反应过程中测得的有关数据如下表:
Cl2(g)+CO(g),反应过程中测得的有关数据如下表:
t/s | 0 | 2 | 4 | 6 | 8 |
N(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法不正确的是
A. 使用催化剂能够改变反应速率
B. 达到6s时,反应停止,不再进行
C. 在8s时,反应容器中各物质的浓度不再发生变化
D. 生成Cl2的平均反应速率,0~2s内平均速率比2~4s大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe] ,有关物质性质如下表所示:
物质 | 性质 |
甘氨酸(NH2CH2COOH) | 易溶于水,微溶于乙醇,两性化合物 |
柠檬酸 | 易溶于水和乙醇,有强酸性和还原性 |
甘氨酸亚铁 | 易溶于水,难溶于乙醇 |
实验过程:
Ⅰ.配制含0.10mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3 :将配制好的绿矾溶液与200mL 1.1mol·L-1NH4HCO3溶液混合,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe :实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20 mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。回答下列问题:

(1)仪器E的名称是_______________。
(2)实验I中:实验室配制绿矾溶液,将铁粉与稀硫酸混合时需要过量的试剂是______。
(3)实验II中:制备FeCO3时应向_______溶液中缓慢加入________溶液,并边加边搅拌,若颠倒试剂滴加顺序可能产生的后果是__________________。
(4)确认C中空气排尽的实验现象是______________。
(5)加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是___________。
(6)洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是_______________(填序号)。
A.热水 B.乙醇溶液 C.柠檬酸溶液
(7)若产品的质量为17.34g,则产率为________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理(平衡移动原理)解释的是
①铁在潮湿的空气中容易生锈
②二氧化氮与四氧化氮的平衡体系,加压缩小体积后颜色加深
③实验室可用排饱和食盐水的方法收集氯气
④钠与氯化钾共融制备钾 Na(l)+KCl(l)![]() K(g)+NaCl(l)
K(g)+NaCl(l)
⑤开启啤酒瓶后,瓶中马上泛起大量泡沫
A. ③④ B. ①② C. ①⑤ D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.5 mol Na和0.5 mol Mg分别投入到过量的m1 g水和m2 g盐酸中,分别得到溶液a和b,若m1 = m2,则a和b的质量关系是 ( )
A.a>bB.a<bC.a=bD.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.元素的存在形态只有两种:化合态和游离态
B.同一元素,呈化合态时,其化合价一定比游离态时高
C.有多少种元素就有多少种物质
D.同一元素在不同的物质中的价态一定不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com