
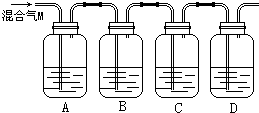
���� ��1��C��Ũ���ᷴӦ����ʽΪC+2H2SO4��Ũ�� $\frac{\underline{\;\;��\;\;}}{\;}$CO2��+2SO2��+2H2O��
��2�����������嶼��ʹ����ʯ��ˮ����ǣ��������������Ư���ԡ���ԭ�ԣ�������ʹƷ����Һ��ɫ���ܱ����Ը�������������÷�Ӧ��Ũ���������������Դ˽����⣻
��3��Bװ�õ������dz�ȥ�����������壻Cװ�õ��������ų���������Ĵ��ڣ�
��� �⣺��1��C��Ũ���ᷴӦ����ʽΪC+2H2SO4��Ũ�� $\frac{\underline{\;\;��\;\;}}{\;}$CO2��+2SO2��+2H2O���ʴ�Ϊ��C+2H2SO4��Ũ�� $\frac{\underline{\;\;��\;\;}}{\;}$CO2��+2SO2��+2H2O��
��2��CO2��SO2���������嶼��ʹ����ʯ��ˮ����ǣ��������������Ư���ԡ���ԭ�ԣ�������ʹƷ����Һ��ɫ���ܱ����Ը���������������Խ��������ͨ���һ��ϴ��ƿ�м����������ͨ��ڶ���ϴ��ƿ�г�ȥ��������ͨ�������ϴ��ƿ���ų���������Ĵ��ڣ����ĸ�ϴ��ƿ���������̼������A����ʢ�ŵ��Լ���Ʒ�죻D����ʢ�Լ�ӦΪ����ʯ��ˮ���ʴ�Ϊ���ڣ��٣�
��3��Bװ�õ������Ǹ��������Һ��ȥ�����������壻Cװ�õ���������Ʒ���ų���������Ĵ��ڣ��ʴ�Ϊ����ȥ�����������壻������������Ƿ������
���� ������Ũ�����̼�ķ�ӦΪ���忼�����ʵļ��飬��ȷ���ʵ������ǽⱾ��ؼ�������CO2��SO2�������������ʵ������ԺͲ��������ʵ�鼴�ɣ�֪���������ʵļ��鷽������Ŀ�ѶȲ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | v��B2��=3 mol/��L•min�� | B�� | v��A2��=4 mol/��L•min�� | ||
| C�� | v��C��=0.03 mol/��L•s�� | D�� | v��B2��=0.08 mol/��L•s�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ħ������g/mol | B�� | ����Ħ�����L/mol | ||
| C�� | ���ʵ���mol/L | D�� | �ܶ�g/cm3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ˮ��������������ʱ������ת��Ϊ��ѧ�� | |
| B�� | úȼ��ʱ����ѧ����Ҫת��Ϊ���� | |
| C�� | ��ɫֲ����й������ʱ��̫����ת��Ϊ��ѧ�� | |
| D�� | �׳�ƹ���ʱ����ѧ����Ҫת��Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������Һ��Ӧ���ɱ����� | |
| B�� | ����Ũ��ˮ���ɰ�ɫ���� | |
| C�� | ���ӵĻ���Һ���Ⱥ����� | |
| D�� | .��������Һ��ͨ��CO2����Һ�ɳ������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com