
| A. | 某溶液的pH=7,则该溶液为中性溶液 | |
| B. | 一定温度下,向AgCl饱和溶液中加入少量NaCl固体,Ksp(AgCl)减小 | |
| C. | 常温下,反应X(s)+Y(l)═2Z(g)不能自发,则该反应的△H>0 | |
| D. | 常温下,0.01mol/L的NaOH溶液中由水电离的c(H+)=1.0×10-2mol/L |
分析 A.某溶液的pH=7,该溶液不一定呈中性,可能为酸性或碱性;
B.溶度积常数只与温度有关,与离子浓度无关;
C.常温下,该反应的△S>0,该反应不能自发进行,说明△G=△H-T△S>0,据此判断△H;
D.酸或碱抑制水电离,常温下,该溶液中由水电离的c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$.
解答 解:A.某溶液的pH=7,如95℃时纯水的pH=6,该温度下,pH=7的溶液呈碱性,故A错误;
B.溶度积常数只与温度有关,与离子浓度无关,虽然NaCl抑制AgCl溶解,但温度不变则Ksp(AgCl)不变,故B错误;
C.常温下,该反应的△S>0,该反应不能自发进行,说明△G=△H-T△S>0,则△H>0,故C正确;
D.酸或碱抑制水电离,常温下,该溶液中由水电离的c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.01}$mol/L=1.0×10-12mol/L,故D错误;
故选C.
点评 本题考查溶液酸碱性判断、溶度积常数影响因素、反应热和焓变、水的电离等知识点,为高频考点,侧重考查学生分析计算能力,注意B中离子积常数只与温度有关,注意D中水电离出氢离子或氢氧根离子计算方法,为易错点.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:解答题
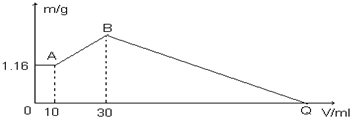
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
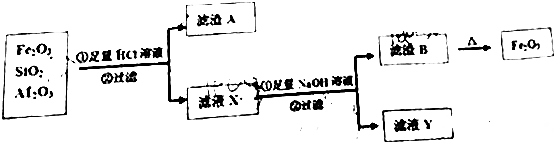
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 | B. | 2.0 | C. | 13.0 | D. | 14.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O、CH4、HF | B. | 红磷、硫、碘 | ||
| C. | CO2、SO2、NO2 | D. | H2SO4、CH3CH2OH、HCHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、HCO3-、NO3- | B. | NH4+、Al3+、SO42-、NO3- | ||
| C. | K+、Fe2+、NH4+、NO3- | D. | NH4+、Na+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
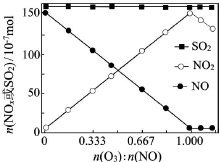 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 g碳完全燃烧时放出热量196.8 kJ | |
| B. | CO的燃烧热△H=-283.0 kJ/mol | |
| C. | H2的燃烧热△H=-241.8 kJ/mol | |
| D. | 制备水煤气的反应热△H=+131.3 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com