
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaHClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
| A、4种 | B、8种 |
| C、12种 | D、16种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
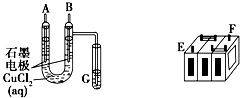 (Ⅰ)某铅蓄电池的正、负极标记被磨损.试用如图装置设计实验,识别出此铅蓄电池的正负极.
(Ⅰ)某铅蓄电池的正、负极标记被磨损.试用如图装置设计实验,识别出此铅蓄电池的正负极.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| X | X原子最外层电子数是次外层的两倍 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与X同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、推广使用无磷洗衣粉 |
| B、使用清洁燃料的公交车 |
| C、减少含硫化石燃料的大量燃烧 |
| D、使用不易降解的一次性塑料餐具 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素X与氢形成原子个数比为1:1的化合物有多种 |
| B、元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
| C、Z的原子半径比Y的原子半径大 |
| D、元素Z可与元素X形成共价化合物XZ2,且各微粒均满足8电子的稳定结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com