
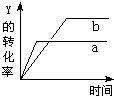
 反应 X(气)+Y(气)?2Z(气)+Q(Q>0),在一定条件下,反应物Y的转化率与反应时间(t)的关系如图所示.若使曲线a变为曲线b可采取的措施是( )
反应 X(气)+Y(气)?2Z(气)+Q(Q>0),在一定条件下,反应物Y的转化率与反应时间(t)的关系如图所示.若使曲线a变为曲线b可采取的措施是( )| A、加入催化剂 | B、降低温度 |
| C、增大压强 | D、增大Y的浓度 |


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
| A、配制盐酸用量筒量取盐酸时俯视刻度线 |
| B、配制盐酸定容时,仰视容量瓶刻度线 |
| C、称量4 g NaOH配制0.1 mol/L NaOH溶液1000 mL时,砝码错放左盘 |
| D、NaOH溶解后未经冷却即注入容量瓶至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某温度下,测得溶液的pH<7 |
| B、溶液中c(Na+)=c(A2-) |
| C、溶液中存在Na+、HA-、A2-、H2A 多种微粒 |
| D、NaHA溶液可与等体积等物质的量浓度的NaOH溶液恰好反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用茚三酮溶液可以鉴别甘氨酸与醋酸 |
| B、用纸层析法分离铁离子与铜离子时,蓝色斑点在棕色斑点的下方,说明铜离子在固定相中分配得更多 |
| C、过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离有机混合物的方法 |
| D、Cl-存在时,铝表面的氧化膜易被破坏,因此含盐腌制食品不宜直接存放在铝制容器中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42- | ||
B、常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中
| ||
| C、将等浓度的K2S和KHSO4两种溶液等体积,则混合溶液中离子浓度的大小关系为:c(K+)>c(SO42-)>c(HS-)>c(OH-)>c(H+)>c(S2-) | ||
| D、常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的3.5倍(已知:Ksp(Cd(OH)2)=7.2×10-15,Ksp(Co(OH)2)=1.8×10-15) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到化学平衡时,2v正(O2)=v逆(SO3) |
| B、达到化学平衡时,容器中气体压强不再变化 |
| C、若单位时间内生成xmolSO3的同时消耗xmolSO2,则反应达到平衡状态 |
| D、达到化学平衡时,容器中混合气体的平均相对分子质量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解熔融CeO2制Ce,铈在阳极获得 | ||||||||
B、铈有四种稳定的核素
| ||||||||
| C、用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ | ||||||||
| D、由于氧化性:Ce4+>Fe3+,而I-有强还原性,所以铈溶于氢碘酸的化学方程式可表示为:2Ce+6HI=2CeI3+3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com