
| 实验顺序 | 实验内容 | 实验现象 | 实验顺序 | 实验内容 | 实验现象 | |
| ① | A+B | 生成白色沉淀 | ④ | B+C | 无明显变化 | |
| ② | A+C | 放出无色气体 | ⑤ | B+D | 生成白色沉淀 | |
| ③ | A+D | 放出无色气体 | ⑥ | C+D | 无明显变化 |
分析 根据反应现象和物质的性质进行推断,由表格中A能与C和D反应均有气体放出,可知A为碳酸钠溶液,C和D溶液均显酸性,则B为氢氧化钡溶液,B和C、D分别混合,B和D有沉淀,可知D为硫酸氢钠溶液,则C为稀盐酸,以此解答该题.
解答 解(1)可分析可知:A为碳酸钠溶液,C为稀盐酸,故答案为:Na2CO3溶液;稀盐酸;
(2)碳酸钠溶液和氢氧化钡溶液混合生成碳酸钡白色沉淀,发生反应的离子方程式为CO32-+Ba2+=BaCO3↓,碳酸钠溶液和硫酸氢钠溶液混合有二氧化碳气体放出,发生反应的离子方程式为CO32-+2H+=CO2↑+H2O,
故答案为:CO32-+Ba2+=BaCO3↓;CO32-+2H+=CO2↑+H2O;
(3)氢氧化钡溶液和硫酸氢钠溶液等体积等物质的量浓度反应生成水和硫酸钡沉淀,发生反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O,从离子反应方程式可看出,等物质的量反应后溶液里剩余阴离子为OH-,
故答案为:Ba2++OH-+H++SO42-=BaSO4↓+H2O;OH-;
(4)实验④中氢氧化钡溶液和盐酸混合没有明显现象,但发生了离子反应生成水,离子反应方程式为H++OH-=H2O,
故答案为:④;H++OH-=H2O.
点评 本题属于表格型推断题,为高考常见题型,侧重考查学生的分析能力以及元素化合物知识的综合理解和运用,考查溶液中物质之间的离子反应,把握两两反应的现象归纳、列表,并和试题信息对照可得出结论,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在水溶液中:H+、I-、NO3-、SiO32- | |
| B. | 饱和氯水中:Cl-、NO3-、Na+、SO3- | |
| C. | 将足量CO2通入时:H+、NH4+、Al3+、SO42- | |
| D. | 加入金属铝产生H2的溶液中:NH4+、Na+、SO42-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 漂白粉的有效成分是Ca(ClO)2 | |
| B. | 漂白粉暴露在空气中久置不会变质 | |
| C. | 漂白粉是由Cl2与石灰乳制得 | |
| D. | 漂白粉变质过程中不涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO:0.001 mol•L-1 | B. | H2O:0.002 mol•L-1 | ||
| C. | NH3:0.002 mol•L-1 | D. | O2:0.001 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 盐酸滴在石灰石上:CO32-+2H+═CO2↑+H2O | |
| D. | 盐酸与饱和的澄清石灰水反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在银片上:2Ag+2H+═2Ag++H2↑ | |
| B. | 氧化铁与稀盐酸混合:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 碳酸钙溶于醋酸溶液中:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | NaHCO3溶液中加入 NaHSO4 溶液:HCO3-+HSO4-═CO2↑+H2O+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
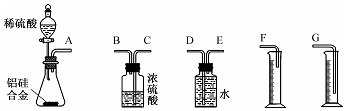
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
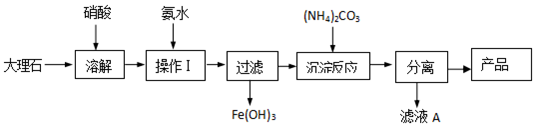
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷中混有乙烯,将其通入酸性高锰酸钾溶液中洗气 | |
| B. | 乙烯中混有二氧化硫,将其通入氢氧化钠溶液中洗气 | |
| C. | 乙炔中混有硫化氢,将其通入溴水中洗气 | |
| D. | 溴苯中混有溴,加入汽油,振荡,用汽油萃取出溴 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com