
 | 1.200 | 1.000 | 0.800 | 0.600 |
| 270 | 3.60 | 3.00 | 2.40 | 1.80 |
| 280 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | 升高温度或增大A的浓度都可以增大v的值 | |
| B. | 同时改变反应温度和A的浓度,v可能不变 | |
| C. | a=6.00 | |
| D. | 270<b<280 |
分析 A.升高温度或增大浓度都能加快化学反应速率;
B.升高温度化学反应速率增大,减小浓度降低反应速率;
C.相同浓度的A物质时,在270℃和280℃条件下的反应速率之比为定值;
D.相同浓度的A物质,温度越高,反应速率越大.
解答 解:A.升高温度增大活化分子百分数,反应速率增大,增大浓度增大单位体积内活化分子个数,反应速率增大,所以升高温度或增大A的浓度都可以增大v的值,故A正确;
B.升高温度化学反应速率增大,减小浓度降低反应速率,所以同时改变反应温度和A的浓度,v可能不变,故B正确;
C.相同浓度的A物质时,在270℃和280℃条件下的反应速率之比为定值,$\frac{9.00}{3.60}=\frac{7.50}{3.00}=\frac{4.50}{1.80}=\frac{a}{2.40}$=2.5,a=6.00,故C正确;
D.相同浓度的A物质,温度越高,反应速率越大,根据表中数据知,相同浓度的A,b温度下A的反应速率小于270℃和280℃条件下的反应速率,所以温度b<270℃,故D错误;
故选D.
点评 本题考查化学平衡有关计算,侧重考查学生理解、分析、计算能力,明确浓度、温度对化学反应速率影响是解本题关键,易错选项是C,注意表中数据的纵横比较,题目难度中等.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②③ | B. | ④①②③ | C. | ②④①③ | D. | ④②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
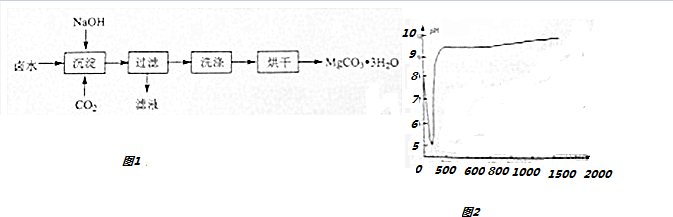
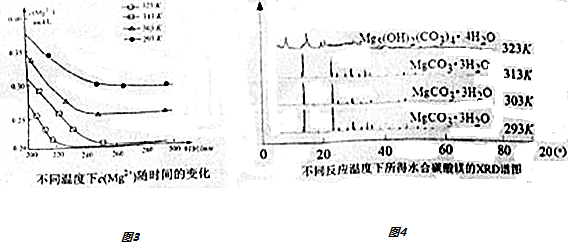
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
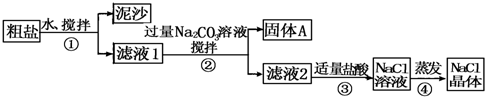
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | 有气泡冒出且烧杯中产生白色沉淀 | 猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入稀盐酸或稀硝酸,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | 猜想II不成立 |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,加入硝酸酸化的硝酸钡溶液 | 产生不溶于稀硝酸的白色沉淀 | 猜想Ⅲ成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验编号 | 操作 | 现象及结论 |
| a | 加入2mL蒸馏水,再加入10mL 5mol/L Na2S2O8溶液,振荡 | 红色固体逐渐溶解,先慢后快. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 已知:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol;
已知:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol;| A. | CO(g)与Na2O2(s)反应放出509kJ热量时,消耗的CO是28g | |
| B. | 如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO的燃烧热为-566 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲的摩尔体积比乙的摩尔体积小 | |
| B. | 甲的物质的量比乙的物质的量多 | |
| C. | 甲的相对分子质量比乙的相对分子质量小 | |
| D. | 甲的分子数比乙的分子数少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com