
 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )| A. | 正极反应中有CO2生成 | |
| B. | 微生物促进了反应中电子的转移 | |
| C. | 质子通过交换膜从负极区移向正极区 | |
| D. | 电池总反应为C6H12O6+6O2═6CO2+6H2O |
分析 A.根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,正极的电极反应式为O2+4e-+4H+═2H2O;
B.葡萄糖在微生物的作用下将化学能转化为电能,形成原电池;
C.原电池中,阳离子向正极移动,所以质子通过交换膜从负极区移向正极区;
D.燃料电池反应式和燃料燃烧方程式相同.
解答 解:A.根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,正极的电极反应式为O2+4e-+4H+═2H2O,因此CO2在负极产生,故A错误;
B.葡萄糖在微生物的作用下将化学能转化为电能,形成原电池,有电流产生,所以微生物促进了反应中电子的转移,故B正确;
C.通过原电池的电极反应可知,负极区产生了H+,根据原电池中阳离子向正极移动,可知质子(H+)通过交换膜从负极区移向正极区,故C正确;
D.该反应属于燃料电池,燃料电池的电池反应式和燃烧反应式相同,则电池反应式为C6H12O6+6O2=6CO2+6H2O,故D正确;
故选A.
点评 本题考查化学电源新型电池,为高频考点,正确判断电解质溶液酸碱性是解本题关键,所有原电池中都是负极上失电子发生氧化反应、正极上得电子发生还原反应,难点是电极反应式的书写.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
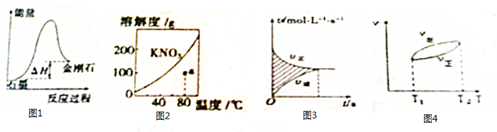
| A. | 由图1可知,从能量角度考虑,金刚石比石墨更稳定 | |
| B. | 图2中a点降温后加入KNO3 固体都能转变成饱和溶液 | |
| C. | 图3中阴影部分的面积表示△v=v正-v逆 | |
| D. | 由图4可知,正反应△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验及现象 | 结论 |
| A | 将湿润的红色石蕊试纸放在试管口,试纸变蓝 | 反应中有NH3产生 |
| B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产生 |
| C | 收集气体的同时测得溶液的pH为8.6 | 弱碱性溶液中Mg也可被氧化 |
| D | 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 | 弱碱性溶液中OH-氧化了Mg |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
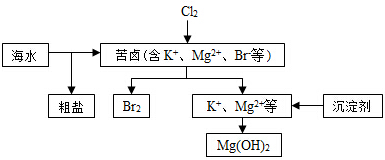
| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂和重结晶等过程提纯 | |
| C. | 工业生产常选用NaOH作为沉淀剂 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
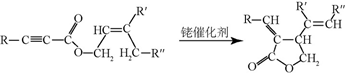
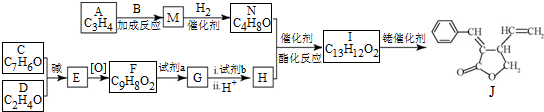

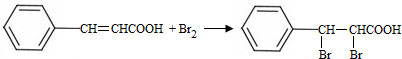 ;试剂b是NaOH、醇溶液.
;试剂b是NaOH、醇溶液.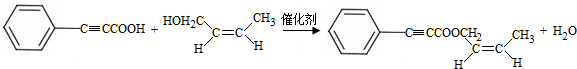 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,H2S浓度增加,表明该反应是吸热反应 | |
| B. | 通入CO后,正反应速率逐渐增大 | |
| C. | 反应前H2S物质的量为7mol | |
| D. | CO的平衡转化率为80% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2CN-+Cl2→(CN)2+2Cl- | B. | (CN)2+H2O→2H++CN-+CNO- | ||
| C. | (CN)2+2OH-→CN-+CNO-+H2O | D. | (SCN)2+2CN-→2SCN-+(CN)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com