
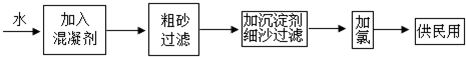
| A. | 由碳燃烧生成CO的热化学方程式是C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=(Q1-0.5Q2)kJ/mol | |
| B. | 由碳燃烧生成1mol CO放出的热量是(Q1-0.5Q2)kJ | |
| C. | 由碳燃烧生成CO的热化学方程式是2C(s)+O2(g)═2CO(g)△H=(Q2-2Q1)kJ/mol | |
| D. | 碳和CO2反应的热化学方程式是C(s)+CO2(g)═2CO(g)△H=(2Q2-2Q1)kJ/mol |
分析 已知由碳单质生成1mol CO2气体放热Q2 kJ,则C燃烧生成 CO2的热化学方程式为:C(s)+O2(g)═CO2(g)△H=-Q2kJ/mol;
18g碳单质的物质的量为$\frac{18g}{12g/mol}$=1.5mol,标准状况下22.4L O2的物质的量为1mol,二者反应生成CO和CO2,反应放出热量是Q1kJ,
设18gC燃烧生成的CO为xmol,生成CO2为ymol,
则x+y=1.5mol,x+2y=2mol,解得x=1mol,y=0.5mol,所以生成1molCO放热为Q1-0.5Q2kJ,据此结合选项分析.
解答 解:已知由碳单质生成1mol CO2气体放热Q2 kJ,则C燃烧生成 CO2的热化学方程式为:C(s)+O2(g)═CO2(g)△H=-Q2kJ/mol;
18g碳单质的物质的量为$\frac{18g}{12g/mol}$=1.5mol,标准状况下22.4L O2的物质的量为1mol,二者反应生成CO和CO2,反应放出热量是Q1kJ,
设18gC燃烧生成的CO为xmol,生成CO2为ymol,
则x+y=1.5mol,x+2y=2mol,解得x=1mol,y=0.5mol,所以生成1molCO放热为Q1-0.5Q2kJ,
A.生成1molCO放热为Q1-0.5Q2kJ,所以由碳燃烧生成CO的热化学方程式是C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-(Q1-0.5Q2)kJ/mol,故A错误;
B.由分析可知,由碳燃烧生成1mol CO放出的热量是(Q1-0.5Q2)kJ,故B正确;
C.生成1molCO放热为Q1-0.5Q2kJ,则由碳燃烧生成CO的热化学方程式是2C(s)+O2(g)═2CO(g)△H=(Q2-2Q1)kJ/mol,故C正确;
D.C燃烧生成 CO2的热化学方程式为:C(s)+O2(g)═CO2(g)△H=-Q2kJ/mol,碳燃烧生成CO的热化学方程式是2C(s)+O2(g)═2CO(g)△H=(Q2-2Q1)kJ/mol,所以由盖斯定律可知,C(s)+CO2(g)═2CO(g)△H=(2Q2-2Q1)kJ/mol,故D正确.
故选A.
点评 本题考查了热化学方程式的书写、反应热的计算、盖斯定律的应用,侧重于考查化学反应与能量知识的综合考查,题目难度中等,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中无法确定Al3+的存在 | |
| B. | 原溶液中不含的离子为:K+、Cu2+、CO32- | |
| C. | 步骤②中可以确定存在Cl-、Fe2+、NO3- | |
| D. | 步骤③中共有2种钡盐沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
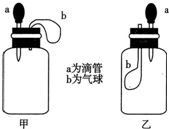 如图所示,挤压胶头滴管(装有液体)a,将液体加入到广口瓶(装有另一种物质)中,两装置中的气球(干瘪)b都有明显地胀大(忽略液体体积对气球的影响,以及外界和广口瓶间热量的传递影响).则所用试剂不可能是( )
如图所示,挤压胶头滴管(装有液体)a,将液体加入到广口瓶(装有另一种物质)中,两装置中的气球(干瘪)b都有明显地胀大(忽略液体体积对气球的影响,以及外界和广口瓶间热量的传递影响).则所用试剂不可能是( )| A. | 甲:H2O和CaO(固体);乙:H2O和NH4NO3(固体) | |
| B. | 甲:盐酸和Na2O2(固体);乙:亚硫酸钠溶液和氯气 | |
| C. | 甲:NaOH溶液和CO2;乙:盐酸和NaHCO3溶液 | |
| D. | 甲:浓H2SO4和蔗糖(固体);乙:H2O和NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
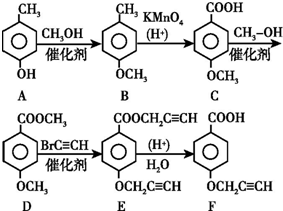
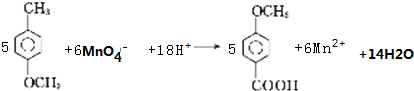 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCH5+与1molNH2-所含电子数均为10NA | |
| B. | 60gSiO2晶体中所含[SiO4]四面体数为0.5NA | |
| C. | 25℃,pH=10的Na2CO3溶液中所含OH-数为1×10-4NA | |
| D. | 标准状况下,22.4LCO、NO混合气体中所含氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
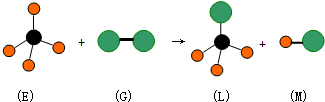
| A. | 反应过程中E中共价键断裂,G中共价键保持不动 | |
| B. | E中存在非极性键 | |
| C. | M分子有可能是HCl | |
| D. | 上述反应的类型是加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||||||
| Y | Z | W |
| A. | 工业上电解YW饱和溶液冶炼金属Y | |
| B. | Y、W的最高价氧化物的水化物均能溶解金属Z | |
| C. | 气态氢化物的稳定性:W>X | |
| D. | 简单离子半径的大小顺序:r(Y+)>r(X-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持容器容积不变,向其加入1molH2(g),反应速率一定加快 | |
| B. | 保持容器容积不变,向其中加入1molN2(N2不参加反应),反应速率一定加快 | |
| C. | 保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率一定加快 | |
| D. | 保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),反应速率一定加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com