
【题目】X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | Q | |
原子半径 | 0.186 | 0.074 | 0.099 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
其他 | 阳离子无核外电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)X和M的原子可构成 18 电子的分子,该分子的结构式为 。
(2)R元素的单质与水反应的离子方程式是 。
(3)Z与Q相比,金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 (填字母序号)。
a.Q的熔点比Z的熔点高,Q的硬度比Z的硬度大
b.Z与冷水反应迅速,而Q与冷水几乎不反应
c.Z的最高价氧化物对应水化物是强碱,而Q的最高价氧化物对应水化物具有两性
(4)与Y元素同主族的短周期元素E在自然界中存在多种核素,它们之间的关系互为 ,其中用于测定一些文物年代的核素的符号为 。
(5)写出Z2M2与X2M反应的化学方程式并标出电子转移关系。
【答案】(1)H—O—O—H
(2)Cl2+H2O=H++Cl-+HclO
(3)Na bc
(4)同位素14C
(5)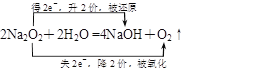
【解析】试题分析:X、Y、Z、M、R、Q是短周期主族元素,X阳离子核外无电子,则X为H元素;Y的化合价主要为-4,+4,是无机非金属材料的主角,则Y为Si元素;Z焰色反应呈黄色,则Z为Na元素;R的主要化合价为-1,+7,则R为Cl元素;Q主要化合价为+3价,原子半径Na>Q>Cl,则Q为Al元素;M的主要化合价为-2价,为第ⅥA族元素,原子半径M<Cl,则M为O元素,即X为H元素;Y为Si元素;Z为Na元素;R为Cl元素;Q为Al元素;M为O元素。
(1)根据上述分析,X和M分别为H、O元素,两者的原子构成的 18 电子的分子为H2O2,该分子的结构式为H—O—O—H。
(2)R为Cl元素,氯气与水反应生成盐酸和次氯酸,反应的离子方程式为Cl2+H2O=H++Cl-+HclO。
(3)Z为Na元素,Q为Al,两者属于同周期元素,从左到右,元素的金属性逐渐减弱,则金属性较强的是Na;a.常温下,Q的熔点比Z的熔点高,Q的硬度比Z的硬度大,这是物质的物理性质,不能说明元素的金属性强弱,a项错误;b.Na与冷水反应迅速,而Al与冷水几乎不反应,说明Na比Al活泼,Na的金属性强,b项正确;C.金属性越强,其最高价氧化物的水化物碱性越强,则Na的最高价氧化物对应水化物是强碱,而Al的最高价氧化物对应水化物具有两性能说明Na的金属性强,c项正确;答案选bc。
(4)与Si元素同主族的短周期元素C在自然界中存在多种核素,它们之间质子数相同,而中子数不相同,关系互为同位素,其中用于测定一些文物年代的核素的符号为14C。
(5)Z2M2与X2M分别为Na2O2和水,过氧化钠与水反应生成氢氧化钠和氧气,则反应的化学方程式且电子转移关系为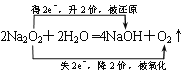 。
。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.Cu溶于稀HNO3:Cu+2 H++NO![]() ===Cu2++NO2↑+H2O
===Cu2++NO2↑+H2O
B.用石墨电极电解饱和食盐水:2 Cl-+2 H2O ![]() 2 OH-+H2↑+Cl2↑
2 OH-+H2↑+Cl2↑
C.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-===Fe(OH)2↓
D.向Fe(NO3)3溶液中加入过量的HI溶液:2 Fe3++2 I-===2 Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,X既能与Y反应又能与Z反应,且都属于复分解反应的是
选项 | X | Y | Z |
A | Cu | HNO3 | Fe(NO3)3 |
B | FeCl3 | Zn | NaHCO3 |
C | O2 | NH3 | SO2 |
D | NH4Al(SO4)2 | Ba(NO3)2 | NaOH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应14CuSO4+5FeS2+12H2O===7Cu2S+5FeSO4+12H2SO4,下列说法正确的是
A. 只有硫酸铜作氧化剂
B. SO42-既不是氧化产物又不是还原产物
C. 被氧化的硫与被还原的硫的质量比为3∶7
D. 1 mol硫酸铜可以氧化![]() mol的硫
mol的硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
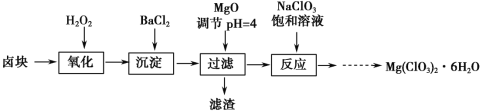
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
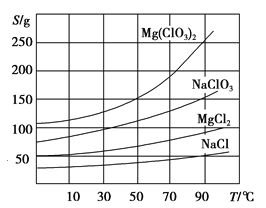
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
(1)过滤所需要的主要玻璃仪器有__ __ _。
(2)加MgO后过滤所得滤渣的主要成分为 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为_________________________。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20.00 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O![]() +6Fe2++14H+=2Cr3++6Fe3++7H2O。
+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:____________________________;
②产品中Mg(ClO3)2·6H2O的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)需要称量NaOH固体 克;
(2)需量取密度为1.19g/cm3、质量分数为36.5%的浓盐酸________mL;
(3)定容时的操作是:继续向容量瓶中加蒸馏水至 ,改用胶头滴管滴加蒸馏水至 。
(4)配制过程中,下列实验操作导致所配制的稀盐酸的物质的量浓度偏大的有 。
A.量取浓盐酸时发现量筒不干净,用水洗净后直接量取 |
B.用量筒量取浓盐酸时仰视观察凹液面 |
C.稀释浓盐酸时,没有冷却就立即转移到容量瓶中 |
D.定容时俯视刻度线 |
E.加蒸馏水时不慎超过了刻度线,用胶体滴管吸出
F.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.同温同压下,相同体积的物质,它们的物质的量一定相等
B.任何条件下,等质量的一氧化二氮(N2O)和二氧化碳所含的分子数必相等
C.1 L一氧化碳的质量一定比1 L氧气质量小
D.等体积、等物质的量浓度的盐酸和硫酸中所含的H+数一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用如图所示装置探究二氧化硫气体的性质.
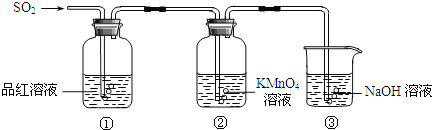
请回答:
(1)实验室用铜和浓硫酸共热制取二氧化硫,反应的化学方程式是 .
(2)当观察到②中溶液颜色变浅时,①中的现象是 .
(3)装置③的作用是 .
(4)①、②中的现象说明二氧化硫具有的性质是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com