
【题目】结合元素周期表回答下列问题:
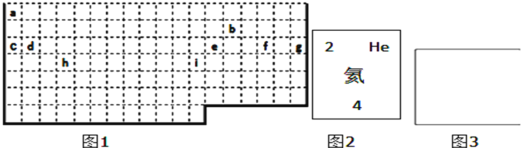
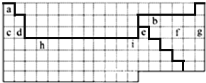
(1)①表中实线是元素周期表的部分边界,请在图1中用实线补全元素周期表的边界________
②请画出金属与非金属的分界线________
③请在方框中(图3)按氦元素的式样写出h元素原子的相关信息________
(2)X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31。
①X是______, Z是______(填写元素名称)
②X, Y, Z 三种元素的简单离子半径大小顺序是_____________________________
③三种元素形成的单质氧化性最强的化学式为______
【答案】
 N S S2-> N3-> O2- O2
N S S2-> N3-> O2- O2
【解析】
根据元素周期表的结构可知,上边界为短周期元素,一周期有2种元素,位于1、18列,二、三周期有8种元素,位于1、2列及13~18列;h元素为钛元素;X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素核内质子数之和为31,平均质子数≈10.3,一定有元素处于第二周期,元素原子的最外层电子数之和为17,设X元素的最外层电子数为x,则Y、Z最外层电子数为x+1或x-1,若Y、Z元素的最外层电子数为x+1,则x+2(x+1)=17,解得x=5,符合题意,即X处于ⅤA族,Y、Z处于ⅥA族,则X为N元素,故Y为O元素、Z为S元素;若Y、Z元素的最外层电子数为x-1,则有x+2(x-1)=17,解得x= ![]() ,不符合题意
,不符合题意
(1)①上边界为短周期元素,一周期有2种元素,位于1、18列,二、三周期有8种元素,位于1、2列及13~18列,补全元素周期表的边界为: 。
。
②最外层电子数≤周期数为金属元素,最外层电子数>周期数为非金属性元素,画出金属与非金属的分界线为: 。
。
③h元素为钛元素,原子序数为22,符号为Ti,相对原子质量为51,其原子的相关信息可以表示为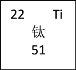 。
。
(2)①综上分析,X是N,Z是S。
②X, Y, Z 三种元素的简单离子为N3-、O2-、S2-,电子层数越多离子半径越大,电子层数相同时,核电荷数越大半径越小,则三种离子的半径大小顺序是S2-> N3-> O2-。
③同周期从左到右、同主族从下到上,非金属单质的氧化性逐渐增强,则三种元素形成的单质氧化性最强的化学式为O2。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】下列关于2甲基1丁烯[CH2=C(CH3)CH2CH3]的说法错误的是( )
A. 与1-丁烯(CH2=CHCH2CH3)互为同系物
B. 官能团有甲基、碳碳双键
C. 该有机物的所有碳原子可能共平面
D. 与环戊烷(![]() )互为同分异构体
)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中的废镍催化剂(主要成分为NiCO3和SiO2,还含有少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:

已知:Ⅰ.NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物;
Ⅱ.Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时为加快反应速率,提高镍元素的浸出率,可以采取的措施有:________。
(2)“滤渣Ⅰ”的主要成分为__(填化学式),该物质在工业上的用途为_________(任写一种)。
(3)“一次碱析”时,加入的NaOH溶液需过量,其目的是_________。
(4)“氨解”发生反应的离子方程式为________。“净化”时通入H2S的目的是_______。
(5)“氧化”时发生反应的化学方程式为_________。
(6)“系列操作”具体是指_________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程。

下列有关说法正确的是
A.制取NaHCO3的反应是先往精盐溶液中通入CO2,再通入NH3
B.氯碱工业在阳极产生使湿润淀粉碘化钾试纸变蓝的气体
C.可直接加热MgCl2·6H2O制备无水MgCl2
D.在步骤④中,SO2水溶液吸收Br2后,溶液的pH值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熟悉和使用中学化学实验中常见仪器及用品是化学学习的基本要求。试回答以下问题:
(1)温度计、量筒、滴定管的一部分如图所示,下列读数(虚线所指刻度)及说法正确的是________(填字母代号)。
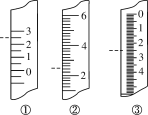
A.①是量筒,读数为2.5 mL
B.②是量筒,读数为2.5 mL
C.③是滴定管,读数为2.5 mL
D.①是温度计,读数为2.5 ℃
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在下列仪器中,没有用到“磨砂”工艺处理的有________(填字母代号)。
a.试管 b.分液漏斗 c.带滴管的试剂瓶(滴瓶) d.集气瓶 e.酸式滴定管f.碱式滴定管
(3)实验室常见的几种气体发生装置如图A、B、C所示:
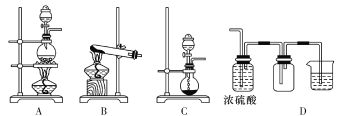
检查装置C气密性的操作方法是________________________。 若用装置A与装置D相连制取、收集气体X,则X可能是下列气体中的________(填数字序号)。
①CO2 ②NO ③Cl2 ④H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物和硫氧化物是常见的空气污染物,含氮氧化物和硫氧化物的尾气需处理后才能排放。
Ⅰ.氮氧化物的处理
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为NO+NO2+2OH=2NO2-+H2O,2NO2+2OH= NO2-+NO3-+H2O,吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是_________(填化学式)。
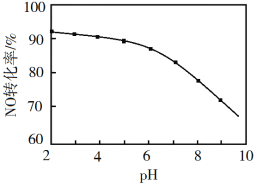
(3)NO的氧化吸收。在酸性NaClO溶液中,HClO氧化NO生成Cl和NO3-。其他条件相同,NO转化为NO3-的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。NaClO溶液的初始pH越小,NO转化率越高。其原因是_________。
Ⅱ.煤燃烧排放的烟气中SO2和NOx的处理
采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NOx的烟气,反应温度为323K,NaClO2溶液浓度为5×103mol·L1 。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
(4)写出NaClO2溶液脱硫过程中主要反应的离子方程式________。增加压强,NO的转化率_________(填“提高”“不变”或“降低”)。
(5)由实验结果可知,脱硫反应速率大于脱硝反应速率。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃、101kPa下,a mL由氢气、乙烯组成的混合气体在b mL氧气中充分燃烧后,恢复到原温度和压强。已知b > 3a,且燃烧后气体体积缩小了b/16mL,则乙烯的体积为( )
A.b/16mL B.b/8mL C.(a- b/8) mL D.(a+ b/8) mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代文献中记载了大量古代化学的研究成果,《本草纲目》中记载:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”,反应原理为:S+2KNO3+3C=K2S+N2↑+3CO2↑。
(1)硫原子的价层电子排布图为_____,烟花燃放过程中,钾元素中的电子跃迁的方式是____,K、S、N、O四种元素第一电离能由大到小的顺序为____。上述反应涉及的元素中电负性最大的是_____(填元素符号)。
(2)碳元素除可形成常见的氧化物CO、CO2外,还可形成C2O3(结构式为![]() )。C2O3与水反应可生成草酸(HOOC—COOH)。
)。C2O3与水反应可生成草酸(HOOC—COOH)。
①C2O3中碳原子的杂化轨道类型为______,CO2分子的立体构型为_____。
②草酸与正丁酸(CH3CH2CH2COOH)的相对分子质量相差2,二者的熔点分别为101℃、-7.9℃,导致这种差异的最主要原因可能是______。
③CO分子中π键与σ键个数比为______。
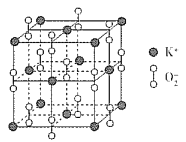
(3)超氧化钾的晶胞结构图如下,则与K+等距离且最近的O2 - 个数为_____,若晶胞参数为dpm,则该超氧化物的密度为___g·cm-3(用含d、NA的代数式表示,设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )
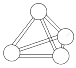
A. N4分子属于一种新型的化合物B. N4分子中只含有非极性键
C. 1 mol N4分子所含共价键数为4NAD. N4沸点比P4(白磷)高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com