
| A. | 向FeCl3饱和溶液中滴加NaOH溶液形成红褐色的分散系 | |
| B. | 一支钢笔使用两种不同牌子的蓝黑墨水,易出现堵塞 | |
| C. | 在河水与海水的交界处,易有三角洲形成 | |
| D. | 水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷 |
科目:高中化学 来源: 题型:填空题
 和一个-Cl,它的可能结构分别是(填写结构简式):CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.
和一个-Cl,它的可能结构分别是(填写结构简式):CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
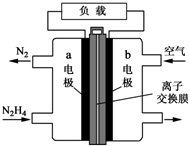 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌跟稀硫酸反应:Zn+2H+=Zn2++H2↑ | |
| B. | 用氯化铁溶液腐蚀铜箔制造印刷电路板:Fe3++Cu=Fe2++Cu2+ | |
| C. | 碳酸钙中加入稀盐酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 单质氯气与水的反应:Cl2+H2O=H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
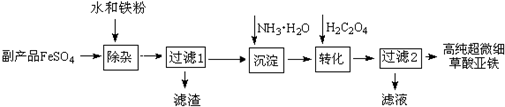
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
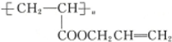 ,则醇A的结构简式为 ( )
,则醇A的结构简式为 ( )| A. | CH3CH2CH2OH | B. | CH2═CHCH2OH | C. | 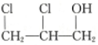 | D. | 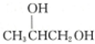 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
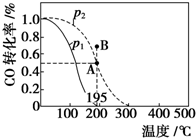 在20L的密闭容器中按物质的量之比为1:2充入CO和H2,发生:CO(g)+2H2(g)?CH3OH(g)△H.测得CO的转化率随温度及不同压强下的变化如图所示,p2和195℃时n(H2)随时间的变化结果如表所示.下列说法正确的是( )
在20L的密闭容器中按物质的量之比为1:2充入CO和H2,发生:CO(g)+2H2(g)?CH3OH(g)△H.测得CO的转化率随温度及不同压强下的变化如图所示,p2和195℃时n(H2)随时间的变化结果如表所示.下列说法正确的是( ) | t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
| A. | p1>p2,△H<0 | |
| B. | 在p2及195℃时,反应前3 min的平均速率v(CH3OH)=0.8 mol•L-1•min-1 | |
| C. | 在p2及195℃时,该反应的平衡常数为25 | |
| D. | 在B点时,v正>v逆 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com