
【题目】我国古代“药金”的冶炼方法是:将炉甘石(ZnCO3)和赤铜矿(Cu2O)与木炭按一定的比例混合后加热至800℃,即可炼出闪烁似金子般光泽的“药金”。下列叙述正确的是( )
A. “药金”实质上是铜锌合金
B. 冶炼炉中炉甘石直接被木炭还原为锌
C. 用王水可区别黄金和“药金”
D. 用火焰灼烧不能区别黄金和药金
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,发生可逆反应mA(g) + nB(g) ![]() pC(g) + qD(g),当m、n、p、q为任意整数时,反应达到平衡的标志是( )
pC(g) + qD(g),当m、n、p、q为任意整数时,反应达到平衡的标志是( )
②体系温度不再改变
③各组分的浓度不再改变
④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应
⑦体系的密度不再变化
A.③④⑤⑥ B.②③④⑥
C.①③④⑤ D.③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图海水综合利用的工业流程图,判断下列说法正确的是( )
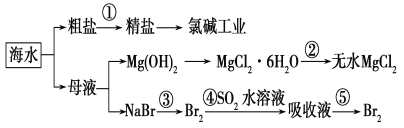
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A. 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B. 在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 从能量角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D. 从第③步到第⑤步的目的是为了浓缩富集溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图实验装置进行实验不能达到目的的是

选项 | 反应及实验目的 | 试剂X | 试剂Y |
A | 电石与饱和食盐水混合,检验乙炔气体 | CuSO4溶液 | 酸性KMnO4溶液 |
B | 二氧化锰与浓盐酸混合加热,验证氯、溴、碘单质氧化性依次减弱 | NaBr溶液 | KI溶液 |
C | 乙醇与浓硫酸加热至170℃,证明发生了消去反应 | NaOH溶液 | Br2的CC14溶液 |
D | 乙酸溶液与碳酸钠固体混合,探究乙酸、碳酸和苯酚的酸性强弱 | 饱和NaHCO3溶液 | 苯酚钠溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上消除氮氧化物的污染,可用如下反应:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法不正确的是
A. 10 min内,T1时v(CH4)T2时小 B. 温度:T1<T2
C. ΔH:a < 0 D. 平衡常数:K(T1)<K(T2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(气)![]() bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
A. 平衡向逆反应方向移动了 B. 物质A的转化率减小了
C. 物质B的质量分数增加了 D. a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。请回答下列问题

I. (1)下列说法正确的是________ .
a.XY2和WY2都能溶子水生成对应的酸
b.Q的含氧酸的酸性比X的含氧酸的酸性强
c.X的最简单气态氢化物的稳定性大于W的最简单气态氢化物的稳定性
d.依据将NaOH溶液分别滴入MgO2、ZQ3溶液中的反应现象可比较Mg和Z金属性的强弱
Ⅱ. QY2是国际上公认的高效消毒灭菌剂。
(2)实验室中利用KQY3和亚硫酸钠在硫酸存在下制备QY2。写出反应的化学方程式,并用单线桥标明电子转移的方向和数目______________________。
(3)自来水厂常用QY2对饮用水进行消毒,处理后的水中要求QY2的浓度在0.10~0.80mg·L-1之间。碘量法可以检测水中QY2的浓度,步骤如下:
操作I :取一定体积的水样,加入一定量的碘化钾,再用NaOH溶液调至中性,并加入淀粉溶液,溶液变蓝。
操作Ⅱ:再加入一定量的Na2S2O3溶液。(己知:2S2O32-+I2 = S4O62-+2I-)。
操作Ⅲ:然后再加硫酸调节水样pH至1~3。
操作时,不同pH环境中Q元素粒子种类及化合价如图所示:

①操作I中反应的离子方程式是_______________________。
②确定操作II完全反应的现象是___________________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是_________________。
④若水样的体积为1.0L,在操作II中消耗了1.0×10-3mol·L-1的Na2S2O3溶液10mL,则水样中QY2的浓度是__________mol·L-1(精确到0.01)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离常数如下表:

下列有关说法正确的是( )
A. 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
B. 等体积、等浓度的HCOONa和NaCN两溶液中所含离子总数目HCOONa大于NaCN
C. NaHS溶液中加入适量 KOH后:c(Na+)=c(H2S)+c(HS-)+2c(S2-)
D. HCOO-、CN-、HS-在溶液中不可以大量共存
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com