
| A. | $\frac{{K}^{+}}{K}$ | B. | $\frac{Mg}{Ca}$ | C. | $\frac{{O}^{2-}}{N{a}^{+}}$ | D. | $\frac{Cl}{C{l}^{-}}$ |
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:解答题
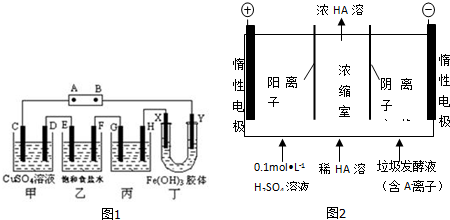
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水、易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  Cu-Zn原电池 | B. |  CuSO4溶液粗铜的精炼 | ||
| C. |  NnCl2溶液铁片镀锌 | D. |  饱和NaCl溶液验证气体产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
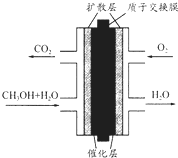 直接甲醇燃料电池(DMFC)有望取代传统电池,它主要由阴极极板、阳极极板和膜电极构成,其中膜电极包括质子膜、催化剂层和气体扩散层(如图).下列关于DMFC工作原理的叙述正确的是( )
直接甲醇燃料电池(DMFC)有望取代传统电池,它主要由阴极极板、阳极极板和膜电极构成,其中膜电极包括质子膜、催化剂层和气体扩散层(如图).下列关于DMFC工作原理的叙述正确的是( )| A. | 通入O2的电极反应式为:O2+4e-+2H2O═4OH- | |
| B. | 电池内部H+由正极渗过交换膜向负极移动 | |
| C. | 甲醇在正极发生反应,电流经过外电路流向负极 | |
| D. | 注入CH3OH的电极反应式为:CH3OH+H2O-6e-═CO2+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
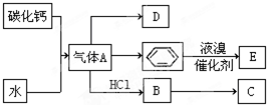
 ;D的最简式CH2=CH2;
;D的最简式CH2=CH2; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr,其反应类型为取代反应.B→C的化学方程式nCH2=CHCl$\stackrel{催化剂}{→}$
+HBr,其反应类型为取代反应.B→C的化学方程式nCH2=CHCl$\stackrel{催化剂}{→}$ ,其反应类型为加聚反应.
,其反应类型为加聚反应.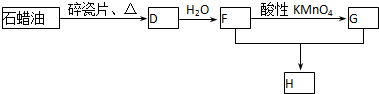
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 8种 | C. | 10种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na202与足量H20反应生成标况下11.2L 02.转移电子的数目为2NA | |
| B. | 标准状况下,2.24L S03中所含电子数为4NA | |
| C. | 用惰性电极电解CuS04溶液后,如果加入0.1mol Cu(0H)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| D. | 0℃和101kp的条件下,1.12L甲烷完全燃烧生成的水分子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com