
【题目】某学生探究0.25mol/LAl2(SO4)3溶液与0.5mol/LNa2CO3溶液的反应,实验如下。
实验1 |
|
实验2 |
|
下列分析正确的是( )
A. 实验1中,白色沉淀a是Al2(CO3)3
B. 实验2中,白色沉淀b一定是Al2(OH)2(CO3)2
C. 检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液
D. 实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
【答案】C
【解析】
由现象可知:实验1发生完全双水解反应生成Al(OH)3,实验2过量的Na2CO3与完全双水解反应生成Al(OH)3发生反应。
A. 实验1中,沉淀溶解,无气泡,白色沉淀a是Al(OH)3,故A错误;
B. 实验2中,沉淀溶解,少量气泡,该气体是CO2,但不能说明白色沉淀b一定是Al2(OH)2(CO3)2,故B错误;
C. 检验白色沉淀a、b是否洗涤干净,即可检验有无SO42-,均可用盐酸酸化的BaCl2溶液检验,故C正确;
D. 实验1、2中,过量Al2(SO4)3溶液显酸性,过量Na2CO3溶液显碱性,不能确定白色沉淀成分不同的原因与混合后溶液的pH有关,故D错误;
答案选C。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】乳酸亚铁([CH3CH(OH)COO]2Fe3H2O,Mr=288)是一种食用的补铁剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,受热易分解,可通过乳酸与碳酸亚铁反应制得。
CH3CH(OH)COOH+FeCO3+2H2O=[CH3CH(OH)COO]2Fe3H2O+CO2↑
FeCO3不溶于水,易被氧化,4FeCO3+6H2O+O2=4Fe(OH)3+4CO2
Ⅰ.乳酸亚铁的制备:
某兴趣小组用FeCl2和NH4HCO3制备FeCO3的装置示意图如图:
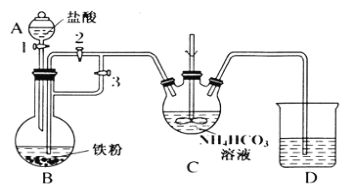
回答下列问题:
(1)C装置中涉及的主要反应的离子方程式_________。
(2)待D处的气体纯净后,将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是_____。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。加入少量铁粉的作用是_______。
(4)反应结束后,无需过滤,除去过量铁粉的方法是_________。
(5)从所得溶液中获得乳酸亚铁晶体的方法是:________,冷却结晶,过滤, 用适量乙醇洗涤,干燥。
Ⅱ.乳酸亚铁晶体纯度的测量:
(6)该兴趣小组用KMnO4滴定法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是___。
(7)经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量,滴定反应如下:Ce4++Fe2+=Ce3++Fe3+。取1.440g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.0500molL-1Ce(SO4)2标准溶液滴定至终点,记录数据如表。
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.20 | 19.95 |
2 | 0.10 | 21.65 |
3 | 0.95 | 20.60 |
则产品中乳酸亚铁的质量分数为________%。(小数点后保留一位数字)
(8)请设计实验证明你购买的乳酸亚铁补铁剂中含Fe2+:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某相对分子质量为40的链状不饱和烃A,能发生如下转化:
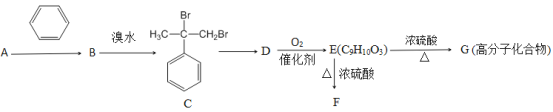
已知:①羟基所连接的碳原子上无氢原子时,难以发生催化氧化;②E能与NaHCO3溶液反应产生气体;③F为酯类化合物。
(1)A的分子式为_____________,A转化为B的反应类型为______________,C转化为D的反应条件为_________________。
(2)B中所含有的官能团的名称为_____________,B中共平面的原子最多有________个。
(3)写出D转化为E的化学方程式:__________________
(4)与E互为同分异构体的芳香族化合物K,已知:①K与E具有相同的官能团;②K不能与FeCl3溶液发生显色反应;③K有二个取代基,则符合上述条件的K共有_________。(填字母代号)
a.3种 b.6种 c. 9种 d.12种
(5)F的结构简式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草木灰主要成分是K2CO3、KCl、K2SO4和不溶于水的杂质。化学实验组为了制取KCl晶体,设计了如下流程。
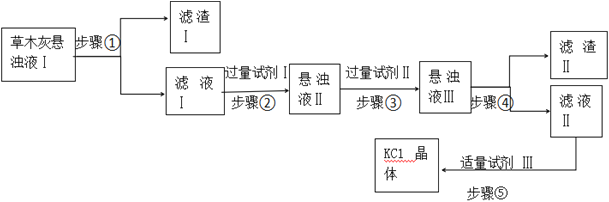 回答下列问题:
回答下列问题:
(1)步骤①中用到的玻璃仪器为:烧杯、_____________。
(2)试剂Ⅲ的名称是__________,步骤⑤操作的名称是________。 可供选择的试剂:BaCl2溶液、Ba(NO3)2溶液、K2CO3溶液、Na2CO3溶液、盐酸。步骤②选择的试剂Ⅰ是___________,发生反应的离子方程式为______________;步骤③选择的试剂Ⅱ是__________,其作用是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水凝胶材料要求具有较高的含水率,以提高其透氧性能,在生物医学上有广泛应用。由N-乙烯基吡咯烷酮(NVP)和甲基丙烯酸![]() -羟乙酯(HEMA)合成水凝胶材料高聚物A的路线如图:
-羟乙酯(HEMA)合成水凝胶材料高聚物A的路线如图:
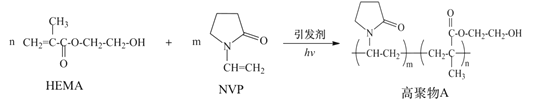
下列说法正确的是
A. NVP具有顺反异构
B. 高聚物A因含有-OH而具有良好的亲水性
C. HEMA和NVP通过缩聚反应生成高聚物A
D. 制备过程中引发剂浓度对含水率影响关系如图,聚合过程中引发剂的浓度越高越好
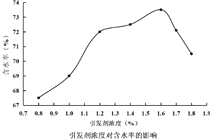
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族。五种元素原子半径与原子序数之间的关系如图所示。下列推断正确的是( )

A. 离子半径:Y<Z
B. 氢化物的沸点:Y<T
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、Y、Z、R四种元素组成的常见化合物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在锌与某浓度的盐酸反应的实验中,实验员得到下面的结果:
锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | 50 |
E | 2 | 薄片 | 45 | 25 |
F | 2 | 粉末 | 15 | 5 |
(1)写出实验中发生反应的离子方程式:___________,该反应是_____反应(填“放热”或“吸热”);
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g锌薄片溶解于酸中需花____ s。
(3)对比结果B与F,解释结果F那么快的原因:________
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体)。
(1)该反应的的化学方程式为_______;
(2)反应开始至2分钟时,X的平均反应速率为______;
(3)能说明该反应已达到平衡状态的是______;
a.每消耗3molX,同时消耗1molY
b.容器内压强保持不变
c.Z的浓度不再变化
d.容器内混合气体的密度保持不变
(4)由下图求得平衡时Y的转化率为_____。
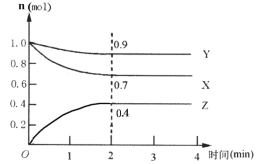
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见物质A~I的转化关系如框图所示,其中A为化合物,B为常见金属单质,H的焰色反应为黄色,Y不使品红溶液褪色。(部分反应条件、溶剂及产物已略去)
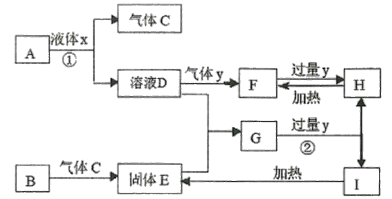
(1)反应①、②的离子方程式________________、__________。
(2)现有含0.10 mol H的溶液,要使其转化成含0.10 mol F的溶液,则:
①若只能加入0.050 mol的某物质,该物质可能是_________________ (填化学式,写1种)。
②若只能加入0.10 mol的某物质,该物质可能是_________________ (填化学式,写1种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)我国化工专家侯德榜的“侯氏制碱法” 又叫“联合制碱法”以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱Na2CO3,有关反应的化学方程式:
(1)____;
(2)____。
(II).取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:①滴加适量H2O2,紫红色褪去,并有气泡产生;②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色; ③最后通入足量的SO2气体。请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为__;
(2)实验③中的现象为__;
(3)实验①、②中反应的离子方程式分别是__、___。
(III)铝与NaOH溶液反应同温同压下,在体积和浓度均为100mL2mol·L1的盐酸和NaOH溶液中各加入等质量的Al,产生气体的体积之比为5∶6,则所加Al的质量为__g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com