
(14分)研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802kJ·mol-1
则CH4(g)+CO2(g) 2CO(g)+2H2(g) △H= kJ·mol-1
2CO(g)+2H2(g) △H= kJ·mol-1
(2)在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。

?据图可知,P1 、P2、 P3 、P4 由大到小的顺序 。
?在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为 。该温度下,反应的平衡常数为 。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g)  CO(g)+H2 (g)来制取。
CO(g)+H2 (g)来制取。
①在恒温恒容下,如果从反应物出发建立平衡,可认定平衡已达到的是
A.体系压强不再变化 B.H2与CO的物质的量之比为1 :1
C.混合气体的密度保持不变 D. 气体平均相对分子质量为15,且保持不变
② 在某密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、
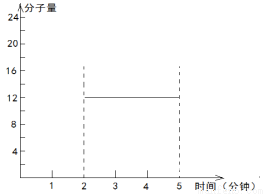
2.2molH2(g)和一定量的C(s),如果此时对体系加压,平衡向 (填“正”或“逆”)反应方向移动,第5min时达到新的平衡,请在下图中画出2~5min内容器中气体平均相对分子质量的变化曲线。

(1)+248
(2)①P4> P3> P2> P1 ;②0.032mol?L-1?min-1 ; 1.64 ;(3)① AC ② 逆
【解析】
试题分析:(1)③-①-②,整理可得CH4(g)+CO2(g)  2CO(g)+2H2(g) △H=+248KJ/mol。(2)①据图可知,甲烷在P1 、P2、 P3 、P4 的转化率的关系是P1 > P2> P3> P4。由于反应CH4(g)+CO2(g)
2CO(g)+2H2(g) △H=+248KJ/mol。(2)①据图可知,甲烷在P1 、P2、 P3 、P4 的转化率的关系是P1 > P2> P3> P4。由于反应CH4(g)+CO2(g)  2CO(g)+2H2(g)的正反应是气体体积增大的反应,根据平衡移动原理,减小压强,平衡向气体体积增大的反应方向即向正反应方向移动。所以这几种条件下的压强由大到小的顺序P4> P3> P2> P1。②在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,此时甲烷的转化率为80%,所以c(CO)=2×0.08=0.16mol/L则v(CO)= 0.016mol/L÷5min=0.032mol/(L·min). 该温度下,反应的平衡常数为
2CO(g)+2H2(g)的正反应是气体体积增大的反应,根据平衡移动原理,减小压强,平衡向气体体积增大的反应方向即向正反应方向移动。所以这几种条件下的压强由大到小的顺序P4> P3> P2> P1。②在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,此时甲烷的转化率为80%,所以c(CO)=2×0.08=0.16mol/L则v(CO)= 0.016mol/L÷5min=0.032mol/(L·min). 该温度下,反应的平衡常数为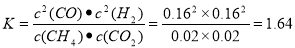 .(3) ① A.由于该反应是反应前后气体体积不等的反应,若反应未达到平衡,则容器的压强就要发生变化,所以体系压强不再变化,能证明反应达到平衡。正确。B.在任何时刻都存在关系:H2与CO的物质的量之比为1 :1,因此不能作为判断平衡的标志。错误。C.由于反应物有固体参加,若反应未达到平衡,则气体的密度就要增大或减小,若达到平衡,气体的密度就不会发生变化。因此混合气体的密度保持不变可以证明反应达到平衡的标志。正确。D. 若气体完全是CO与氢气,由于生成的二者的物质的量的比为1:1,气体平均相对分子质量为15,若气体完全是水蒸气,则气体的相对分子质量为18,由于可逆反应达到平衡状态时是三者的共同体,所以气体的平均相对分子质量应该在15~18,且保持不变。错误。②对于C(s)+H2O(g)
.(3) ① A.由于该反应是反应前后气体体积不等的反应,若反应未达到平衡,则容器的压强就要发生变化,所以体系压强不再变化,能证明反应达到平衡。正确。B.在任何时刻都存在关系:H2与CO的物质的量之比为1 :1,因此不能作为判断平衡的标志。错误。C.由于反应物有固体参加,若反应未达到平衡,则气体的密度就要增大或减小,若达到平衡,气体的密度就不会发生变化。因此混合气体的密度保持不变可以证明反应达到平衡的标志。正确。D. 若气体完全是CO与氢气,由于生成的二者的物质的量的比为1:1,气体平均相对分子质量为15,若气体完全是水蒸气,则气体的相对分子质量为18,由于可逆反应达到平衡状态时是三者的共同体,所以气体的平均相对分子质量应该在15~18,且保持不变。错误。②对于C(s)+H2O(g)  CO(g)+H2 (g),若增大压强,根据平衡移动原理,应该向气体体积减小的方向就是向逆反应方向移动。在第2分钟时混合气体的平均相对分子质量为:
CO(g)+H2 (g),若增大压强,根据平衡移动原理,应该向气体体积减小的方向就是向逆反应方向移动。在第2分钟时混合气体的平均相对分子质量为: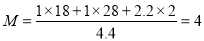 。第5min时达到新的平衡,假如生成物完全转化为反应物,则混合气体的物质的量减小1mol,质量减轻12g,所以混合气体的相对分子质量不变,的平均相对分子质量仍然是12。2~5min内容器中气体平均相对分子质量的变化曲线如图:
。第5min时达到新的平衡,假如生成物完全转化为反应物,则混合气体的物质的量减小1mol,质量减轻12g,所以混合气体的相对分子质量不变,的平均相对分子质量仍然是12。2~5min内容器中气体平均相对分子质量的变化曲线如图:
 。
。
考点:考查盖斯定律的应用、化学反应速率的计算、化学平衡常数的表达式、化学平衡状态的判断、影响化学平衡的因素、相对分子质量与压强的关系的知识。


科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:选择题
如图所示,下列叙述正确的是( )

A.隔膜左侧溶液的质量增加,隔膜右侧溶液的液面升高
B.ZnSO4溶液与CuSO4溶液可以互换
C.X与滤纸接触处有氧气生成
D.Y与滤纸接触处有气泡产生,溶液逐渐变红
查看答案和解析>>
科目:高中化学 来源:2013-2014海口市第二学期高二化学期中考试(B卷)试卷(解析版) 题型:选择题
鉴别CH3OCH3和CH3CH2OH可采用化学方法和物理方法,下列方法不能对二者进行鉴别的是
A.利用金属钠或金属钾 B.利用质谱法
C.利用红外光谱 D.利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高三下学期联考理综化学试卷(解析版) 题型:实验题
(14分)高锰酸钾广泛用作氧化剂、防腐剂、消毒剂、除臭剂及解毒剂。常见的制备流程如下:
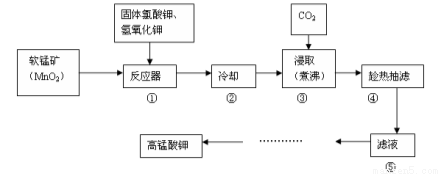
已知:a.3MnO2+KClO3+6KOH=3K2MnO4+KCl+3H2O B.3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
请回答下列问题:
(1)步骤①中反应所选用的坩埚不能用 。
A.石英坩埚 B.铁坩埚 C.瓷坩埚 D.石墨坩埚
(2)步骤③通CO2的目的是为了调节溶液的pH,能否改用氯化氢 (填“能”或“否”),原因是 。
(3)步骤④中抽滤得到的固体是 。
(4)抽滤装置主要由 、安全瓶、抽气泵和布氏漏斗四部分组成,该实验中抽滤时能否用滤纸?______(填“能”或“不能”), 理由是_____。
(5)从滤液⑤得到高锰酸钾的后续操作步骤是____。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高三下学期联考理综化学试卷(解析版) 题型:选择题
五种短周期元素的某些信息如表所示:
元素 | 有关信息 |
X | 最高价氧化物对应的水化物能与其气态氢化物反应生成盐 |
Y | M层上有3个电子 |
Z | 短周期元素中原子半径最大的主族元素 |
W | 其单质是淡黄色固体 |
Q | 最高正价与最低负价代数和为6 |
下列说法正确的是
A.简单离子的半径大小顺序为:W>Q>Z>Y
B.Z单质在氧气中燃烧后的产物不能使品红溶液褪色
C.单质熔点高低的顺序为:Z>Y>X
D.Z与W元素只能形成原子个数比为2:1的化合物
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省湖州市高三二模理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.纤维素和乙酸酐作用可生成纤维素三乙酸酯和乙酸
B.环戊二烯( )分子中所有碳原子共平面
)分子中所有碳原子共平面
C.七叶内酯(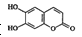 )和东莨菪内酯(
)和东莨菪内酯(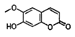 )都是某些中草药中的成分,它们具有相同的官能团,互为同系物
)都是某些中草药中的成分,它们具有相同的官能团,互为同系物
D.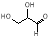 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应
该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省温州市业水平考试适应性测试化学试卷(解析版) 题型:填空题
(4分)拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能。下表是某些共价键的键能:
共价键 | H-H | O=O | H-O |
键能/kJ ·mol-1 | 436 | 498 | X |
根据下图中能量变化图,回答下列问题:

(1) 图中:a=___________。
(2) 表格中:X= 。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省温州市业水平考试适应性测试化学试卷(解析版) 题型:选择题
下列物质的水溶液中,呈碱性的是
A.Na2CO3 B. Na2SO4 C.NH4Cl D. KAl (SO4) 2
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高一下学期期中化学试卷(解析版) 题型:简答题
(12分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
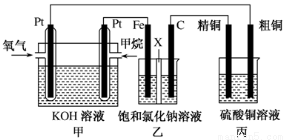
(1)甲烷燃料电池负极反应式是 ;
(2)石墨(C)极的电极反应式为 ;
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成 的气体体积为________L ,丙装置中阴极析出铜的质量为________g ;
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。

若用于制漂白液,a为电池的________极,电解质溶液最好用________;若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用________作电极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com