

| A. | 在 pH 为 6.37 及 10.25 时,溶液中 c(H2CO3)=c(HCO3-)=c(CO32-) | |
| B. | 反应 HCO3-+H2O?H2CO3+OH-的平衡常数为 10-7.63 | |
| C. | 0.1 mol•L-1NaHC2O4溶液中 c(HC2O4-)+2c(C2O42-)+c(H2C2O4)=0.1 mol•L-1 | |
| D. | 往 Na2CO3溶液中加入少量草酸溶液,发生反应:CO32-+H2C2O4=HCO3-+HC2O4- |
分析 A、据图分析在pH为6.37时溶液中无碳酸根离子,pH=10.25时,溶液中无碳酸分子;
B、反应HCO3-+H2O?H2CO3+OH-的平衡常数为K=$\frac{c({H}_{2}C{O}_{3})•c(O{H}^{-})}{c(HC{{O}_{3}}^{-})}$,据pH=6.37时计算;
C、据物料守恒分析;
D、往Na2CO3溶液中加入少量草酸溶液,能够生成碳酸氢根离子和C2O42-.
解答 解:A、在pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-),故A错误;
B、反应HCO3-+H2O?H2CO3+OH-的平衡常数为K=$\frac{c({H}_{2}C{O}_{3})•c(O{H}^{-})}{c(HC{{O}_{3}}^{-})}$,pH=6.37时,c(H2CO3)=c(HCO3-),K=c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-6.37}}$=10-7.63,故B正确;
C、在0.1mol•L-1NaHC2O4溶液中有c(C2O42-)、c(HC2O4-)和c(H2C2O4),据物料守恒c(C2O42-)+c(HC2O4-)+c(H2C2O4)=c(Na+)=0.1mol•L-1,故C错误;
D、草酸的酸性比碳酸强,往Na2CO3溶液中加入少量草酸溶液,能够生成碳酸氢根离子和C2O42-,发生反应:2CO32-+H2C2O4=2HCO3-+C2O42-,故D错误;
故选B.
点评 本题考查了据图分析不同pH时溶液中离子的存在形式,注意利用电荷守恒和物料守恒分析,题目难度中等,侧重于考查学生的分析能力和计算能力.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 氢氧化铝与足量盐酸反应:Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠和冷水反应:Na+2H2O═Na++H2↑+OH- | |
| D. | 过量二氧化碳与苛性钾反应:CO2+2OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 环境污染 |  白色污染 |  雾霾 |  臭氧空洞 |  酸雨 |
| 产生原因 | 聚乙烯等塑料 | 胶体的丁达尔效应 | 氟利昂的泄漏 | 煤的直接燃烧 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染” | |
| B. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 | |
| C. | 2015 年 10 月,中国科学家屠呦呦获得诺贝尔生理学或医学奖,以表彰她从青蒿中提取了青蒿素(C15H22O5),这种药品可以有效降低疟疾患者的死亡率 | |
| D. | 原子吸收光谱仪一般用于测定物质中的非金属元素,红外光谱仪可用于测定有机化合物中的官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁丝在氯气中燃烧:Fe+Cl2$\frac{\underline{\;点燃\;}}{\;}$FeCl2 | |
| B. | 常温下,0.1mol/L醋酸溶液pH≈3 CH3COOH?CH3COO-+H+ | |
| C. | 铝片放入氢氧化钠溶液中有气体产生 2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| D. | 蔗糖与浓硫酸混合产生刺激性气味的气体 C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
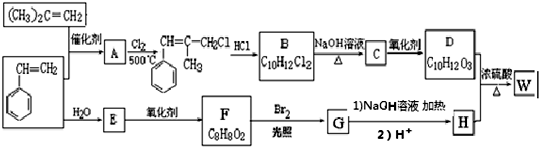
 .
.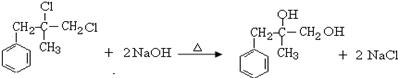 ;由D生成高分子化合物的方程式为
;由D生成高分子化合物的方程式为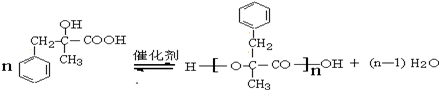 .
.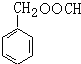 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为吸热反应 | |
| B. | 该反应中,SO2为还原剂 | |
| C. | 1 mol H2S中含有的共价键的数目为3 mol | |
| D. | 常温下,H2S的还原性强于S的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | E(反应物)>E(生成物) | B. | E(反应物)<E(生成物) | C. | 反应放热 | D. | 反应吸热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com