
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:不详 题型:填空题
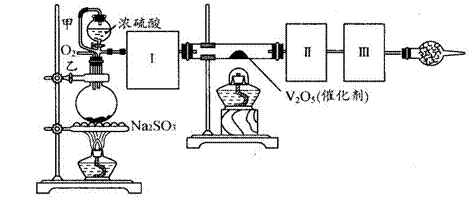
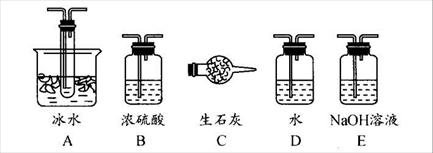
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.灼热的铂丝与NH3、O2混合气接触,铂丝保持红热,说明氨的氧化反应是放热反应 |
| B.某雨水的pH小于5.6,说明雨水中一定溶解了SO2 |
C.某溶液中加入氯化钡溶液,生成白色沉淀,说明原溶液中一定含有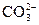 |
| D.将镁条和铝片用导线连接再插进稀NaOH溶液,镁条上产生气泡,说明镁比铝活泼 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 5CO2+11H2O+2K2SO4+4MnSO4
5CO2+11H2O+2K2SO4+4MnSO4
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 使用说明书 | |
| 主要成分 | 活性分子碘(I2),含量1.5 mg/片 |
| 贮藏 | 遮光、密闭、在阴凉处保存 |
| 有效期 | 二年 |
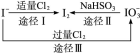
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 序号 | A | B | C | D | ||
| 装置 | 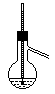 | 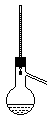 | 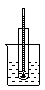 |
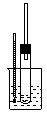 | ||
| 实验 | 乙烯的制取 | 石油的分馏 | 银镜反应 | 苯的硝化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
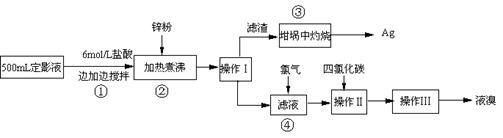

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com