
 .
.
 .
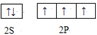
.分析 (1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,核外电子排布式为1s22s22p3;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,离子核外都有18个电子,则B为Cl,C为K;
(3)D元素的正三价离子的3d轨道为半充满,3d轨道电子数为5,原子核外电子排布式为1s22s22p63s23p63d64s2;
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,应为Cu,原子序数为29.
解答 解:(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,核外电子排布式为1s22s22p3,为N元素,其价层电子排布图为  ,
,
故答案为:N; ;
;
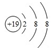
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,则B为Cl元素、C为K元素,钾离子结构示意图为: ,
,
故答案为:氯; ;
;
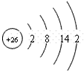
(3)D元素的正三价离子的3d亚层为半充满,原子核外电子排布式为1s22s22p63s23p63d64s2,为Fe元素,原子结构示意图为: ,
,
故答案为:Fe;1s22s22p63s23p63d64s2; ;
;
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,核外电子数为2+8+18+1=29,故E为Cu元素,核外电子排布式为:1s22s22p63s23p63d104s1,
故答案为:Cu;1s22s22p63s23p63d104s1.
点评 本题考查核外电子排布规律、结构与位置关系,注意理解能量最低原理、泡利原理、洪特规则及特例,比较基础.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯30°C时即可发生硝化反应,比苯的硝化容易,是由于甲基对苯环的影响 | |
| B. | 苯不能被酸性高锰酸钾溶液氧化而甲苯可以,是由于甲基对苯环的影响 | |
| C. | 苯酚可以与浓溴水发生取代反应,比苯的溴代容易,是由于羟基对苯环的影响 | |
| D. | 由于苯环和取代基的相互影响导致二者的性质均有变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
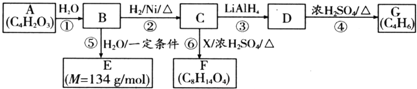
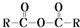 $\stackrel{H_{2}O}{→}$2RCOOH
$\stackrel{H_{2}O}{→}$2RCOOH 、
、 .
.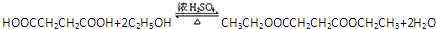 .
.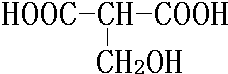 、
、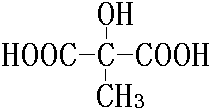 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ④CH≡CH ⑤NH3 ⑥CH4.
④CH≡CH ⑤NH3 ⑥CH4.| A. | ①②③ | B. | ①⑤⑥ | C. | ②③④ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14.3% | B. | 12.5% | C. | 87.5% | D. | 85.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
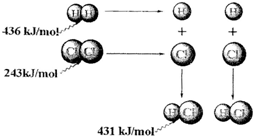
| A. | 氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量 | |
| B. | 436 kJ/mol是指断开1 mol H2中的H-H键需要放出436 kJ的能量 | |
| C. | 431kJ/mol是指生成2 mol HCl中的H-Cl键需要放出431 kJ的能量 | |
| D. | 氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com