
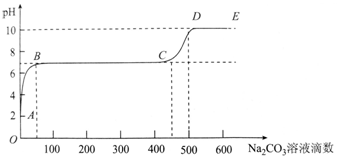
| A. | 开始时溶液pH=2是因为残留液中还有盐酸剩余 | |
| B. | BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加 | |
| C. | 滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+) | |
| D. | AB发生的反应为:Ca2++CO32-═CaCO3↓ |
分析 根据图象可知,用大理石和稀盐酸制备CO2后的残留液pH=2,溶液显酸性,则说明盐酸剩余,即A点溶液中含CaCl2和过量的盐酸;
向残留液中加入碳酸钠溶液,则Na2CO3和HCl反应:Na2CO3+2HCl=2NaCl+CO2+H2O,导致溶液的pH升高,即AB段;
在B点时,溶液的pH=7,则此时Na2CO3将盐酸恰好完全反应,即B点溶液中的溶质只有NaCl和CaCl2;
继续滴加碳酸钠溶液,则Na2CO3和CaCl2反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,即BC段,溶液的pH不变;
在C点时,溶液中的CaCl2完全反应,继续滴加碳酸钠溶液,碳酸钠过量,由于碳酸钠为强碱弱酸盐,水解显碱性,故溶液的pH生高,即CD段,据此进行分析.
解答 解:根据图象可知,用大理石和稀盐酸制备CO2后的残留液pH=2,溶液显酸性,则说明盐酸剩余,即A点溶液中含CaCl2和过量的盐酸;
向残留液中加入碳酸钠溶液,则Na2CO3和HCl反应:Na2CO3+2HCl=2NaCl+CO2+H2O,导致溶液的pH升高,即AB段;
在B点时,溶液的pH=7,则此时Na2CO3将盐酸恰好完全反应,即B点溶液中的溶质只有NaCl和CaCl2;
继续滴加碳酸钠溶液,则Na2CO3和CaCl2反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,即BC段,溶液的pH不变;
在C点时,溶液中的CaCl2完全反应,继续滴加碳酸钠溶液,碳酸钠过量,由于碳酸钠为强碱弱酸盐,水解显碱性,故溶液的pH生高,即CD段,
A.用大理石和稀盐酸制备CO2后的残留液pH=2,溶液显酸性,则说明盐酸剩余,故A正确;
B.BC段溶液的pH不变,是由于Na2CO3和CaCl2反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,离子方程式为:Ca2++CO32-═CaCO3↓,故碳酸钙沉淀的量增多,故B正确;
C.滴入500滴碳酸钠溶液后,溶液的pH大于7,则c(OH-)>c(H+),故C正确;
D.由于残留液中有盐酸剩余,故向残留液中加入碳酸钠溶液,AB段发生Na2CO3和HCl反应:Na2CO3+2HCl=2NaCl+CO2+H2O,离子方程式为:CO32-+2H+=CO2+H2O,故D错误;
故选D.
点评 本题考查了难溶物溶解平衡及沉淀转化的本质,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握难溶物溶解平衡及其影响因素,试题培养了学生的灵活应用能力.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| A. | BaSO4的溶解度增大,Ksp不变 | B. | BaSO4的溶解度、Ksp均增大 | ||
| C. | BaSO4的溶解度、Ksp均不变 | D. | BaSO4的溶解度不变,Ksp增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CO体积分数% 投料比 | 温度/℃ | ||||
| 200 | T2 | T3 | T4 | ||
| $\frac{n({H}_{2}0)}{n(C0)}$ | 1 | 1.70 | 2.73 | 6.00 | 7.85 |
| 3 | 0.21 | 0.30 | 0.84 | 1.52 | |
| 5 | 0.02 | 0.06 | 0.43 | 0.80 | |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Al3+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、Fe3+、NO3- | |
| C. | FeCl3溶液:K+、Na+、NO3-、SCN- | |
| D. | 由水电离出的C(H+)=10-13mol/L的溶液:Na+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精着火时应立即用水灭火 | |
| B. | 实验室制蒸馏水时应在蒸馏烧瓶中放入几粒碎瓷片 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 用试管加热碳酸氢钠固体时使试管口竖直向上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com