
A、电子式 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
B、比例模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 |
C、结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
D、原子结构示意图 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
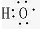 中氧原子最外层7个电子,只能表示羟基,不能表示氢氧根离子;
中氧原子最外层7个电子,只能表示羟基,不能表示氢氧根离子; 为V型,不能表示二氧化碳的比例模型;
为V型,不能表示二氧化碳的比例模型; 为硫离子,硫离子能够破坏水的电离平衡;
为硫离子,硫离子能够破坏水的电离平衡; 的核电荷数=核外电子数=6,表示所有的C原子.
的核电荷数=核外电子数=6,表示所有的C原子.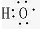 只能表示羟基,不能表示氢氧根离子,氢氧根离子正确的电子式为:
只能表示羟基,不能表示氢氧根离子,氢氧根离子正确的电子式为: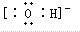 ,故A错误;
,故A错误; 为V型,可以表示水的比例模型,不能表示二氧化碳,故B错误;
为V型,可以表示水的比例模型,不能表示二氧化碳,故B错误; 的阴离子中,当n=16时,表示的为硫离子,硫离子能够结合水电离的氢离子,破坏了水的电离平衡,故C错误;
的阴离子中,当n=16时,表示的为硫离子,硫离子能够结合水电离的氢离子,破坏了水的电离平衡,故C错误; 为C原子,表示所有的碳原子,既可以表示12C,也可以表示14C,故D正确;
为C原子,表示所有的碳原子,既可以表示12C,也可以表示14C,故D正确;

科目:高中化学 来源: 题型:
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 用铂丝蘸取溶液进行颜色反应,观察到火焰呈黄色. | 该溶液一定是钠盐溶液 |
| C | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| D | 常温下,将Al箔插入浓HNO3中,无明显现象. | 铝和浓硝酸不反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na与足量O2反应,随温度升高生成Na2O的速率逐渐加快 |
| B、Na2O和Na2O2中的阴阳离子个数比不相等 |
| C、用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色说明原溶液中有Na+无K+ |
| D、25℃,NaHCO3在水中的溶解度比Na2CO3的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 催化剂 |
| 容器 | 甲 | 乙 | 丙 |
| 起始物质投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 、2molNH3 |
| 达到平衡的时间 /min | t | 5 | 8 |
| 平衡时N的浓度/mol.L-1 | c1 | 3 | |
| N的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度/g.L-1 | ρ1 | ρ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙与盐酸的反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| B、等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-=Mg(OH)2↓ |
| C、氧化铜与稀H2SO4反应:CuO+2H+=Cu2++H2O |
| D、金属钠跟水反应:2Na+2H2O=2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应体系中所有含氧物质中均有18O |
| B、反应体系中含18O的分子有2种 |
| C、可能生成45g乙酸乙酯 |
| D、不可能生成88g乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 测同浓度的Na2CO3、CH3COONa 溶液的PH值前者大 | 酸性强弱:CH3COOH 比H2CO3强 |
| B | 向某溶液加入盐酸酸化的氯化钡溶液有沉淀产生 | 说明此溶液中一定含SO42- |
| C | 向Na2SiO3溶液中通入CO2 出现浑浊 | 非金属性强弱:C>Si |
| D | 比较H2O和H2S的沸点前者大 | 非金属性:O>S |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向0.1 mol?L-1NH4 Cl溶液中通入大量氨气:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B、0.1 mol?L-1的醋酸与0.01 mol?L-1的醋酸相比,前者[H+]大于后者[H+]的10倍 |
| C、已知Ka(HF)=7.2×10-4,Ka(HCN)=4.9×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 |
| D、NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com